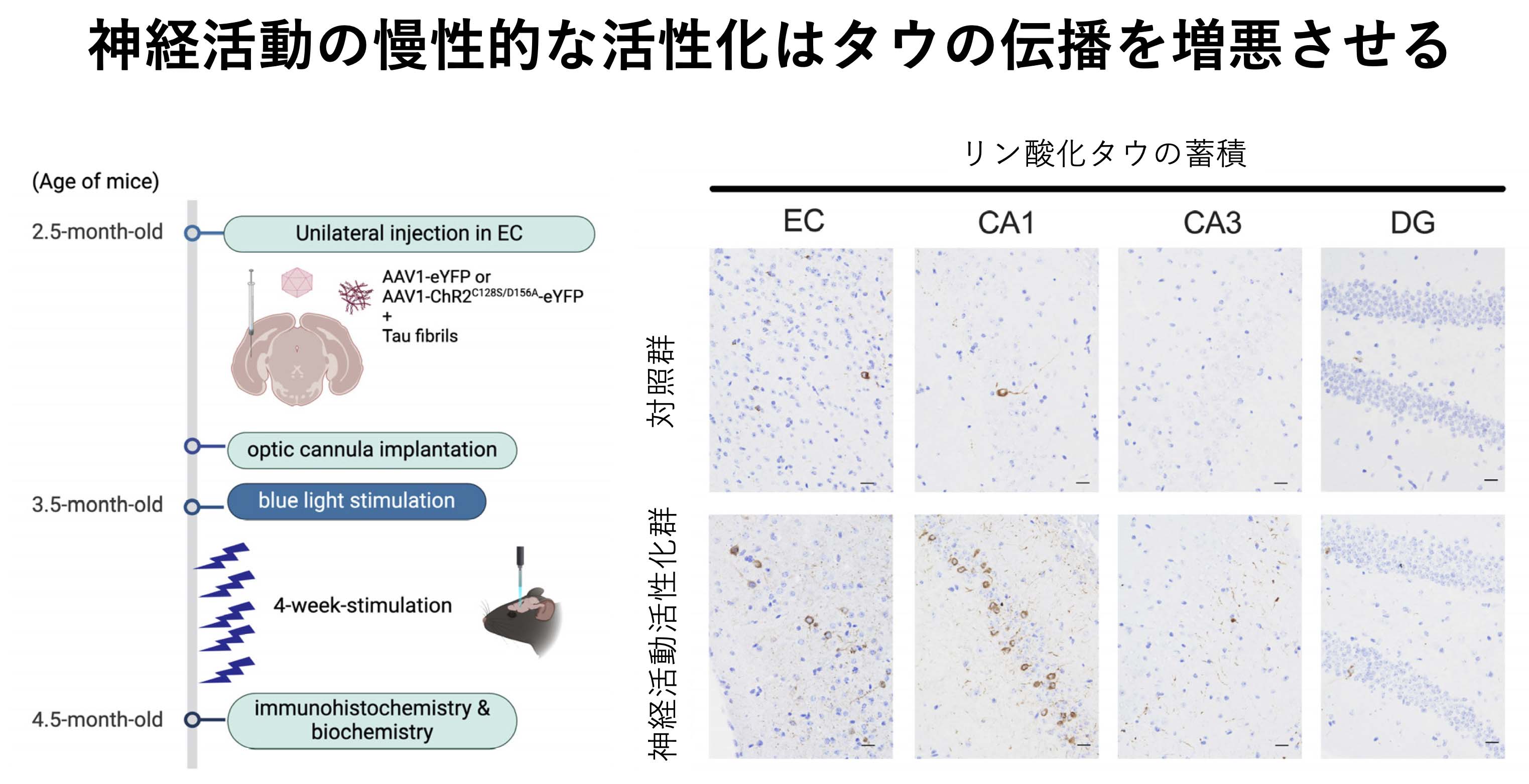
最近の研究成果
2024年8月20日
新しい論文をInternational Journal of Molecular Sciencesに発表しました
Chronic Neuronal Hyperexcitation Exacerbates Tau Propagation in a Mouse Model of Tauopathy
Itaru Nishida, Kaoru Yamada, Asami Sakamoto, Tomoko Wakabayashi, Takeshi Iwatsubo
Int. J. Mol. Sci. 2024, 25(16), 9004; https://doi.org/10.3390/ijms25169004 (registering DOI)
タウの蓄積はアルツハイマー病において神経細胞死の原因となることが知られています。アルツハイマー病患者脳では、タウの蓄積は嗅内皮質と呼ばれる脳領域から始まり、海馬へと伝播していくことが知られていましたが、この原因となるメカニズムは不明でした。私たちは光遺伝学の手法を用いて、嗅内皮質から海馬への神経回路を慢性的に刺激すると、タウの伝播が増悪することを発見しました。これまで初期のアルツハイマー病では神経活動がむしろ亢進していることが示唆されてきました。本研究は神経活動の活性化とタウの伝播増悪の因果関係を示した点において、重要な知見と考えられます。
論文へのリンクはこちら。
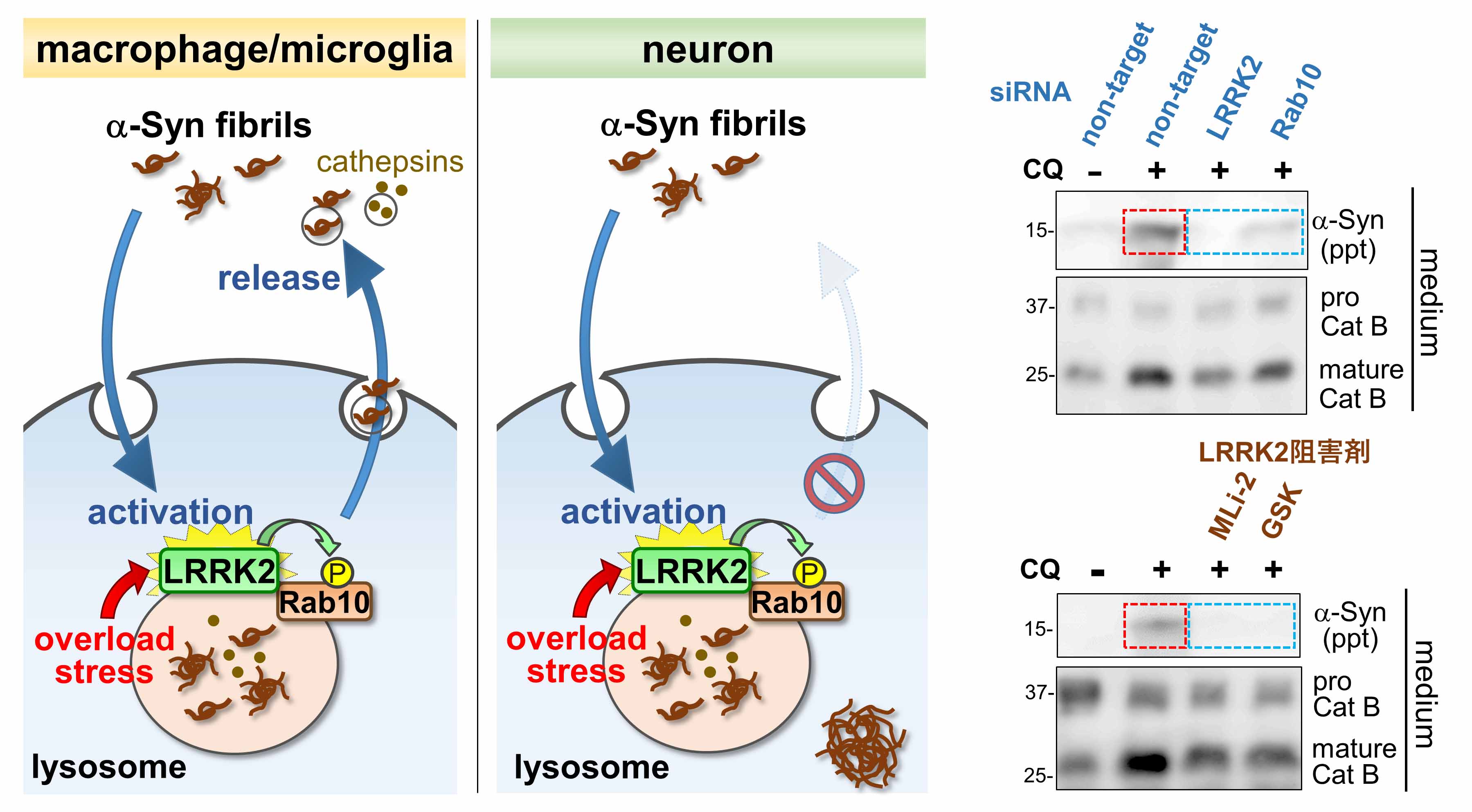
2024年1月23日
新しい論文をiScienceに発表しました
Lysosomal stress drives the release of pathogenic α-synuclein from macrophage lineage cells via the LRRK2-Rab10 pathway
Tetsuro Abe*, Tomoki Kuwahara*, Shoichi Suenaga, Maria Sakurai, Sho Takatori, Takeshi Iwatsubo (*co-first author)
iScience 27(2):108893, 2024, doi: 10.1016/j.isci.2024.108893
典型的なパーキンソン病(PD)脳においては線維化したαシヌクレインタンパク質(α-Syn)の蓄積が認められ、そのようなPDの病因遺伝子としてLRRK2がよく知られています。しかし、α-Syn蓄積とLRRK2をつなぐメカニズムはこれまで不明でした。LRRK2は細胞小器官であるリソソームにストレスを与えると活性化し、リソソーム内容物の細胞外放出を促します。今回私たちは、α-Syn線維を取り込んだマクロファージやミクログリアにリソソームストレスを加えると、不溶性α-Synが速やかに細胞外に放出されることを見出しました。この放出はLRRK2とその基質であるRab10に依存しており、さらにエクソソームの機構を介していること、マクロファージ系細胞特異的に生じることも分かりました。一方、細胞に暴露されたα-Syn線維はリソソームに運ばれるとともに、LRRK2をリソソーム膜に動員して活性化することも見出しました。これらの発見は、ミクログリアなどのマクロファージ系細胞ではα-Syn線維が取り込まれるとLRRK2の活性化を介してα-Synがエクソソームとともに再放出されることを示しており、この機構がα-Syn線維の蓄積や生体内伝播に寄与している可能性があると考えられます。
論文へのリンクはこちら。
本研究はScienceFeatured.comにて紹介されました。(2024.3.28)
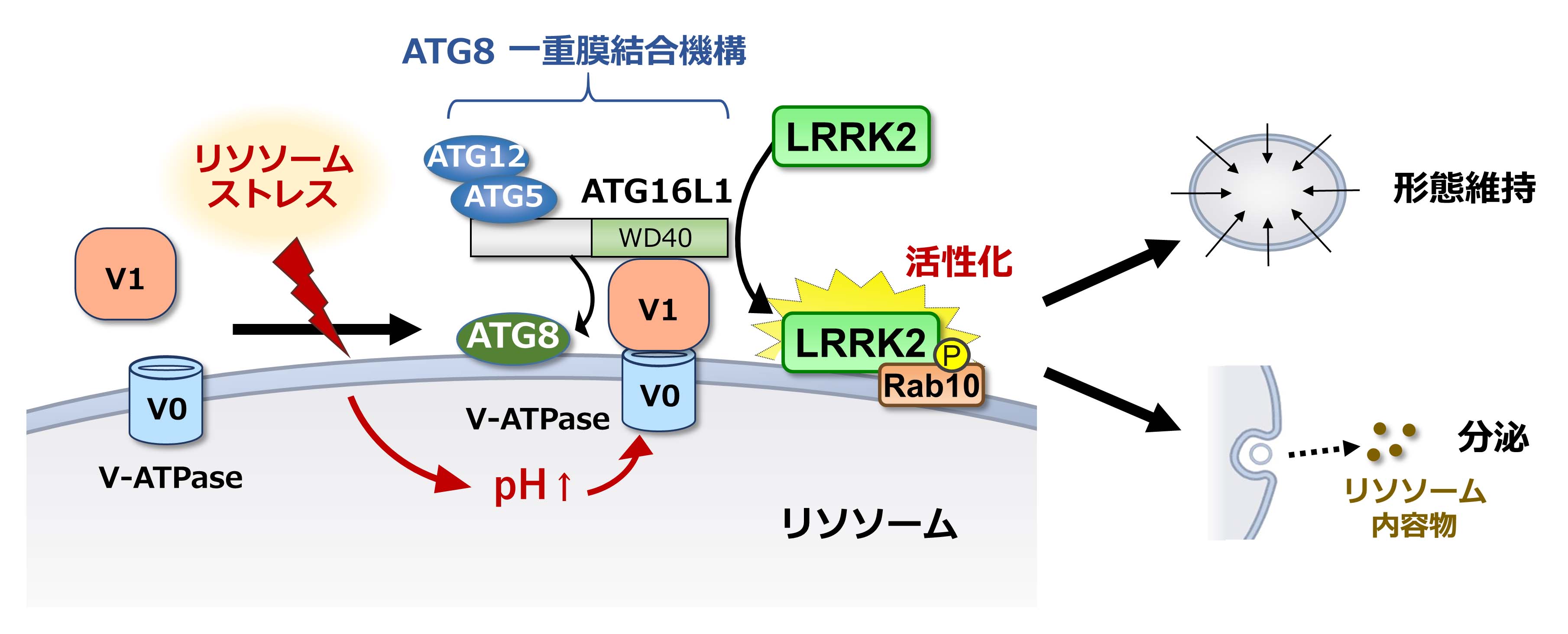
2024年1月17日
新しい論文をJournal of Cell Biologyに発表しました
The V-ATPase-ATG16L1 axis recruits LRRK2 to facilitate the lysosomal stress response
Tomoya Eguchi*, Maria Sakurai*, Yingxue Wang, Chieko Saito, Gen Yoshii, Thomas Wileman, Noboru Mizushima, Tomoki Kuwahara, Takeshi Iwatsubo (*co-first author)
J. Cell Biol. 223(3):e202302067, 2024, doi: 10.1083/jcb.202302067
LRRK2は家族性および孤発性パーキンソン病(PD)にかかわるタンパク質リン酸化酵素(キナーゼ)であり、その異常な活性化がPDの背景にあることが示唆されています。LRRK2はストレスを受けたリソソーム上に局在化することで活性化しますが、そのメカニズムは多くが不明でした。今回私たちは、オートファジーに必須の機構として従来知られていた「ATG8結合系」が、オートファジーとは異なる「ATG8 一重膜結合機構」を介して、LRRK2をリソソーム上に局在化させることを見出しました。特に、この機構の詳細な分子メカニズムとして近年報告された「V-ATPase-ATG16L1軸」が、LRRK2のリソソーム膜局在化および活性化を制御することが分かりました。さらにこの機構は、LRRK2活性化を介してリソソームストレス応答に働き、ストレスを受けたリソソームの形態調節や内容物放出をもたらすことが分かりました。これらの結果は、LRRK2の異常活性化機構の理解につながるとともに、そのメカニズムへの介在がPDの治療戦略になる可能性を示すものです。本研究は東大・水島研究室および英国East Anglia大学との共同研究として行われました。
論文へのリンクはこちら。
プレスリリースはこちら。
日本経済新聞、文教速報デジタル版
解説記事をAutophagy誌に発表しました。(2024.3.19)
2023年10月30日
新しい論文をJournal of Neuroscienceに発表しました
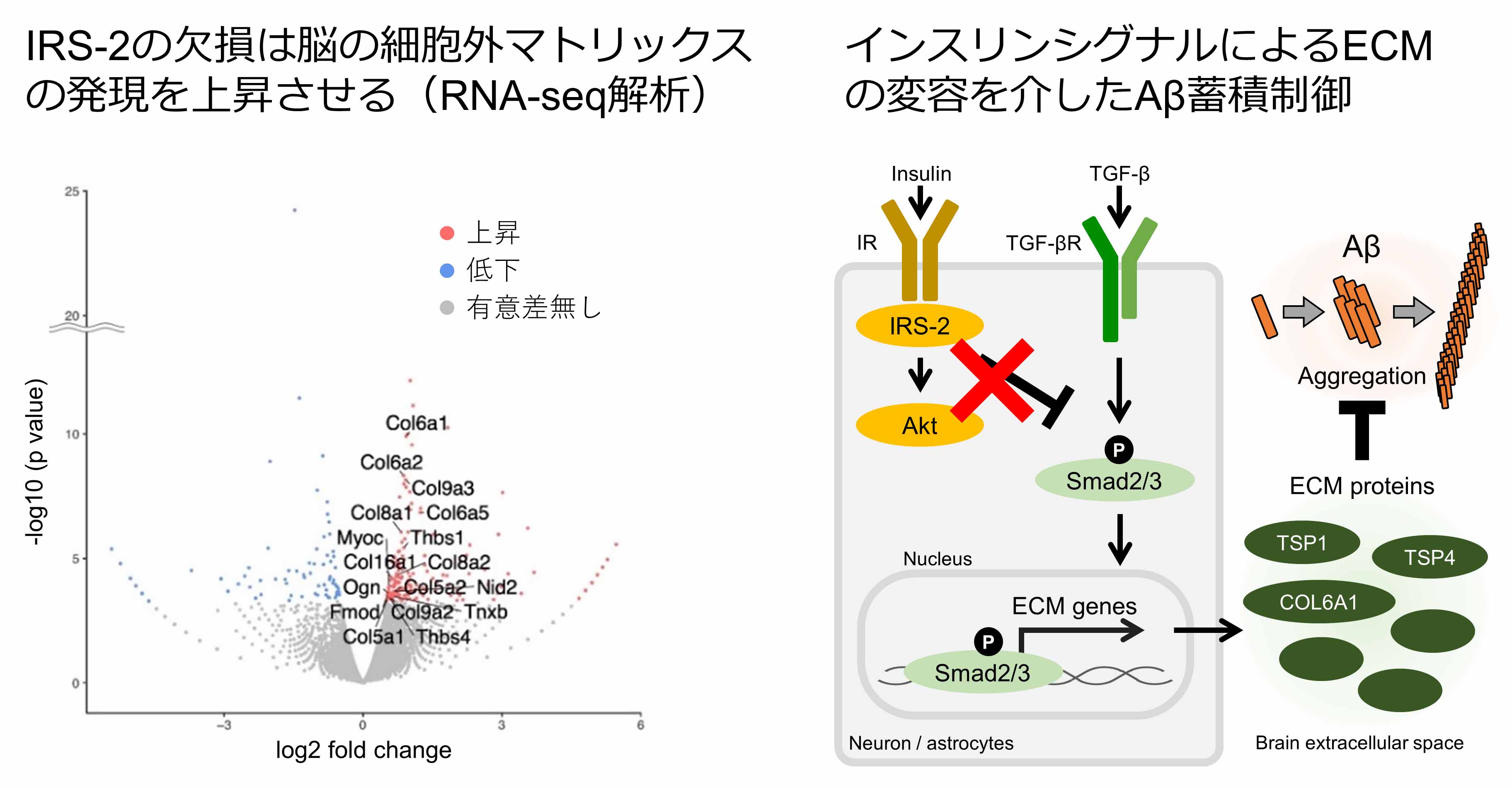
Genetic reduction of insulin signaling mitigates amyloid-β deposition by promoting expression of extracellular matrix proteins in the brain
Toshiharu Sano, Toshitaka Ochiai, Takeru Nagayama, Ayaka Nakamura, Naoto Kubota, Takashi Kadowaki, Tomoko Wakabayashi and Takeshi Iwatsubo
J Neurosci 43:7226-7241, 2023, doi: 10.1523/JNEUROSCI.0071-23.2023
インスリンシグナルの阻害は、様々な動物種において寿命の延長や老化の抑制などのポジティブな効果をもたらします。これまでに、私たちを含む複数のグループの研究から、インスリンシグナル伝達に関わる分子の遺伝的欠損が、アルツハイマー病モデルマウスの脳におけるアミロイドβ(Aβ)の蓄積を顕著に抑制することが示されていました(Wakabayashi et al., Mol Neurodegener 2019; Ochiai et al., Neurobiol Dis 2021)。しかし、その背景にある分子機序は未解明でした。私たちは網羅的遺伝子発現解析を行い、インスリン受容体基質2(IRS-2)の欠損が、脳内の細胞外マトリックス(ECM)発現を増加させること、そしてその制御にTGF-β/Smadシグナルが関与している可能性を見出しました。これらのECM分子はAβの線維化を阻害する作用を示し、また、IRS-2欠損マウスの脳では、Aβ凝集核(シード)の注入により誘導されるアミロイド蓄積が顕著に抑制されました。これらの結果から、インスリンシグナルに関連した抗老化作用のひとつとして、脳ECMの変容を介したAβ凝集の制御を新たに提唱しました。
論文へのリンクはこちら。
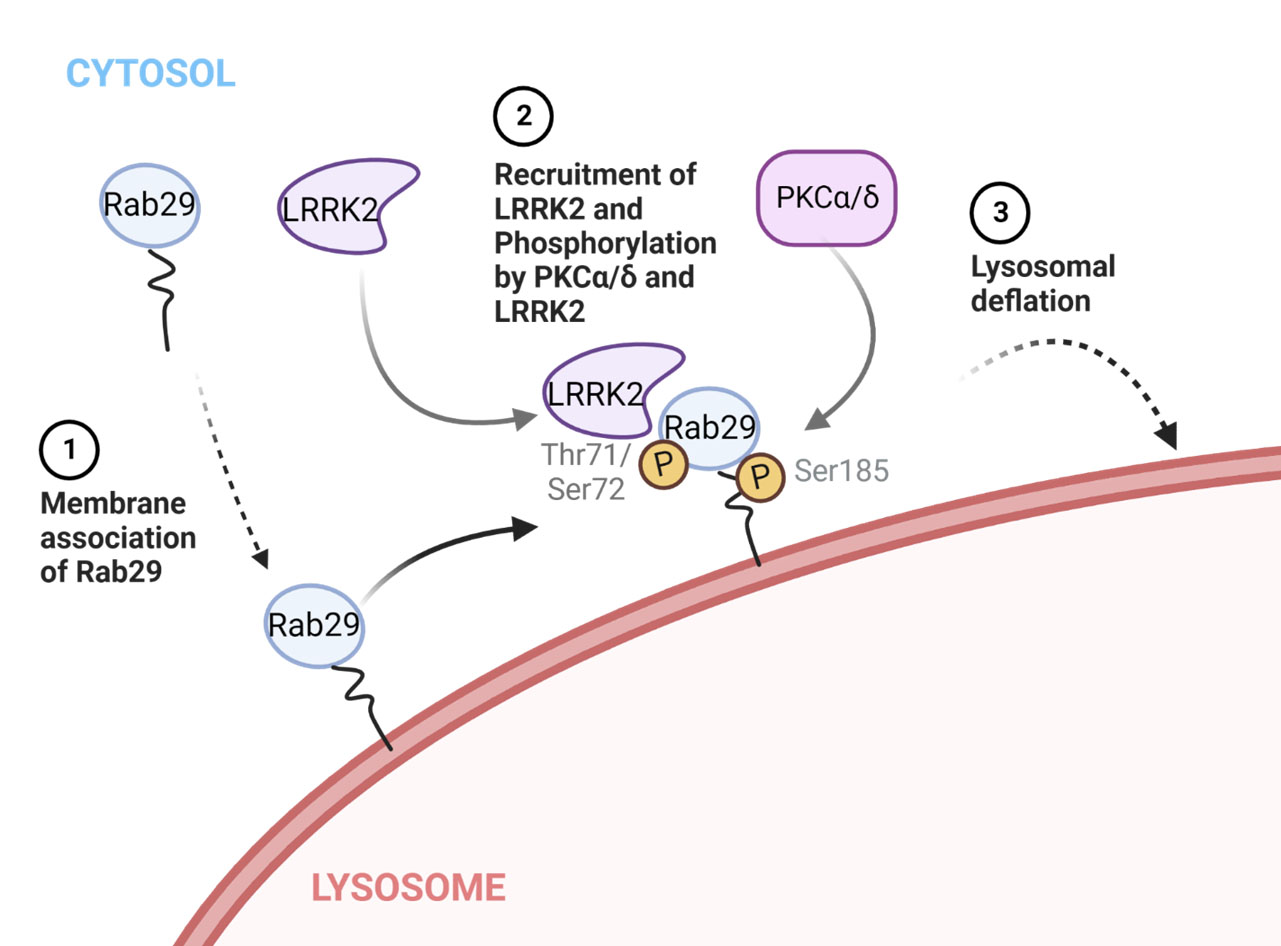
2023年6月27日
新しい論文をJournal of Cell Scienceに発表しました
Phosphorylation of Rab29 at Ser185 regulates its localization and role in the lysosomal stress response in concert with LRRK2
Tadayuki Komori*, Tomoki Kuwahara*, Tetta Fujimoto, Maria Sakurai, Ikuko Koyama-Honda, Mitsunori Fukuda, Takeshi Iwatsubo (*co-first author)
J. Cell Sci. June 27, 2023, doi: 10.1242/jcs.261003
Rab29は孤発性パーキンソン病(PD)のリスク遺伝子座PARK16にコードされる遺伝子であり、その産物はPD病因キナーゼであるLRRK2の基質になることが知られています。私たちはこれまでに、Rab29がリソソームストレス下でLRRK2のリソソーム局在化と活性化をもたらす因子として働くことを報告しました(Eguchi et al, PNAS 2018, Kuwahara et al, Neurobiol Dis 2020)。一方、Rab29自身がどのようにしてリソソームストレスに応答し機能するかは不明でした。今回、私たちはRab29がリソソームストレス下でLRRK2非依存的にリン酸化を受けることを見出し、質量分析からその部位としてSer185を同定しました。また、Ser185リン酸化はリソソームの肥大化調節に関わること、PKCの一部のアイソフォームがリン酸化に関わること、PKCとLRRK2がそれぞれRab29のリソソーム膜への局在化を制御することを見出しました。これらの結果は、細胞が有するリソソーム恒常性維持機構の一端を明らかにするものであると同時に、Rab29とLRRK2が関わるPD発症機構にも新たな洞察をもたらすものと考えられます。
論文へのリンクはこちら。
First person interview
2022年12月8日
新しい論文をNew England Journal of Medicineに発表しました
Trial of Lecanemab in Early Alzheimer’s Disease
Christopher H. van Dyck, Chad J. Swanson, Paul Aisen, Randall J. Bateman, Christopher Chen, Michelle Gee, Michio Kanekiyo, David Li, Larisa Reyderman, Sharon Cohen, Lutz Froelich, Sadao Katayama, Marwan Sabbagh, Bruno Vellas, David Watson, Shobha Dhadda, Michael Irizarry, Lynn D. Kramer, Takeshi Iwatsubo
N Engl J Med. Nov 29, 2022, doi: 10.1056/NEJMoa2212948
アルツハイマー病のメカニズムに即した治療法(疾患修飾療法)として、病因タンパク質であるアミロイドβ(Aβ)を除去する抗体療法が注目されています。このたびエーザイ社、バイオジェン社により臨床開発の進められてきた抗Aβ抗体レカネマブの臨床第3相検証試験において、主要評価項目である全般臨床症状評価指標CDR-SBスコアが、投与18カ月時点においてレカネマブ投与群がプラセボ投与群と比較して27%の悪化抑制を示すなどの有効性を示す結果が、11月29日(日本時間30日)に米国サンフランシスコで開催された第15回アルツハイマー病臨床試験会議(CTAD:Clinical Trials on Alzheimer’s Disease)ならびにNew England Journal of Medicine誌で公表されました。岩坪は研究結果解析チームに加わるとともに、CTAD学会で発表セッションのモデレータを務めました。
本成果は、NHKニュース[1]、[2]、日本経済新聞、朝日新聞アピタルなどで報道されました。
論文へのリンクはこちら。
2022年2月28日
新しい論文をJournal of Experimental Medicineに発表しました
Glymphatic system clears extracellular tau and protects from tau aggregation and neurodegeneration
Kazuhisa Ishida*, Kaoru Yamada*, Risa Nishiyama, Tadafumi Hashimoto, Itaru Nishida, Yoichiro Abe, Masato Yasui, Takeshi Iwatsubo (*co-first author)
J Exp Med. 219(3):e20211275, 2022, doi: 10.1084/jem.20211275
タウは、アルツハイマー病をはじめとする様々な神経変性疾患で脳に蓄積して、神経細胞の死を招く、認知症の原因となるタンパク質です。しかしながらタウの蓄積を防止することにより神経細胞死を食い止める治療法は、これまでに開発されていませんでした。私たちはタウが脳内から除去される仕組みを明らかにすることが認知症の発症予防に繋がると考え、脳の細胞外での体液の流れに着目しました。マウスを用いた実験で脳内の老廃物を除去するグリアリンパ系(グリンパティックシステム)の仕組みによって、タウタンパク質が脳内から脳脊髄液に移動し、その後、頚部のリンパ節を通って脳の外へ除去されていること、またこの過程にアクアポリン4 (AQP4) というタンパク質が関与していることを明らかにしました。さらにAQP4を欠損し、脳からのタウの除去が低下しているマウスでは、神経細胞内のタウ蓄積が増加し、神経細胞死も助長されることがわかりました。本研究において、アルツハイマー病をはじめとする様々な認知症性疾患の原因となるタウが、脳から除去されるメカニズムが初めて明らかになりました。この除去過程に関わるAQP4を欠損したマウスでは、タウの蓄積と神経細胞死が亢進したことから、タウの除去の低下は、認知症発症の原因の1つとして重要であるものと予想されます。本研究で見出されたタウの除去機構を促進することが可能となれば、タウの蓄積や神経細胞死を防止し、アルツハイマー病などの様々な認知症の新規の予防・治療法の開発につながることが期待されます。
論文へのリンクはこちら。
プレスリリースはこちら。
本研究成果はNHK web、Alzforum、日本経済新聞、毎日新聞、マイナビニュースに掲載されました。

2021年9月16日
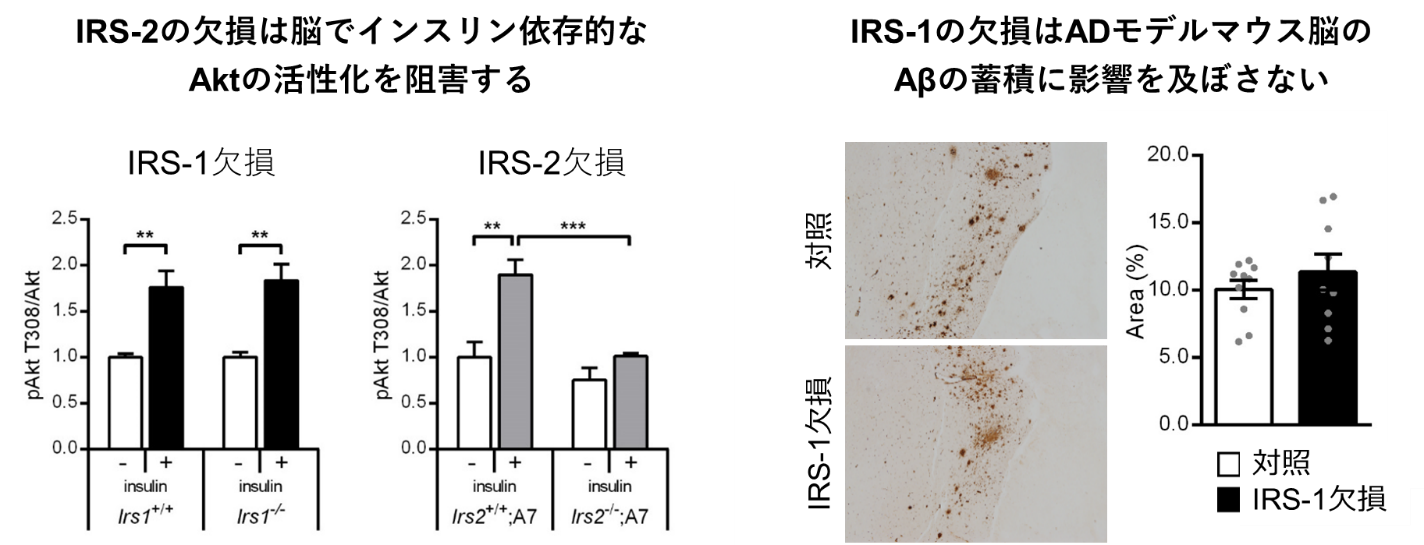
新しい論文をNeurobiology of Diseaseに発表しました
Differential involvement of insulin receptor substrate (IRS)-1 and IRS-2 in brain insulin signaling is associated with the effects on amyloid pathology in a mouse model of Alzheimer's disease
Toshitaka Ochiai*, Toshiharu Sano*, Takeru Nagayama, Naoto Kubota, Takashi Kadowaki, Tomoko Wakabayashi, Takeshi Iwatsubo (*co-first author)
Neurobiol Dis. 159:105510, 2021, doi: 10.1016/j.nbd.2021.105510
2型糖尿病とその中核病態であるインスリン抵抗性は、アルツハイマー病(AD)の発症や脳のAβ沈着にも関与しています。一方、インスリン/IGF-1シグナル経路の構成要素であるインスリン受容体基質(IRS)-2などを遺伝学的に欠損すると、ADモデルマウス脳のAβ蓄積が抑制されることも知られ、脳のインスリンシグナルはADの病態形成において重要かつ多面的な役割を担うと考えられます。本研究では、シグナル伝達の鍵分子であるIRS-1とIRS-2を欠損させたADモデルマウスを作製し、脳のインスリンシグナル活性化とADの病理に対する両者の相対的な寄与を調べました。その結果、脳のインスリンシグナル活性化にIRS-1の欠損は顕著な影響を与えませんでしたが、IRS-2の欠損は下流のAktの活性化を著しく阻害しました。AD病理の解析では、脳のAβレベルやアミロイド斑蓄積、タウのリン酸化は、IRS-2の欠損によってのみ有意に変化することを示しました。これらの結果から、脳のインスリンシグナル伝達ではIRS-2が主要な役割を果たしていることが示されました。また本研究の結果は、インスリンシグナルの低下が脳内で抗アミロイド作用を発揮するという仮説を更に補強するものでした。
論文へのリンクはこちら。
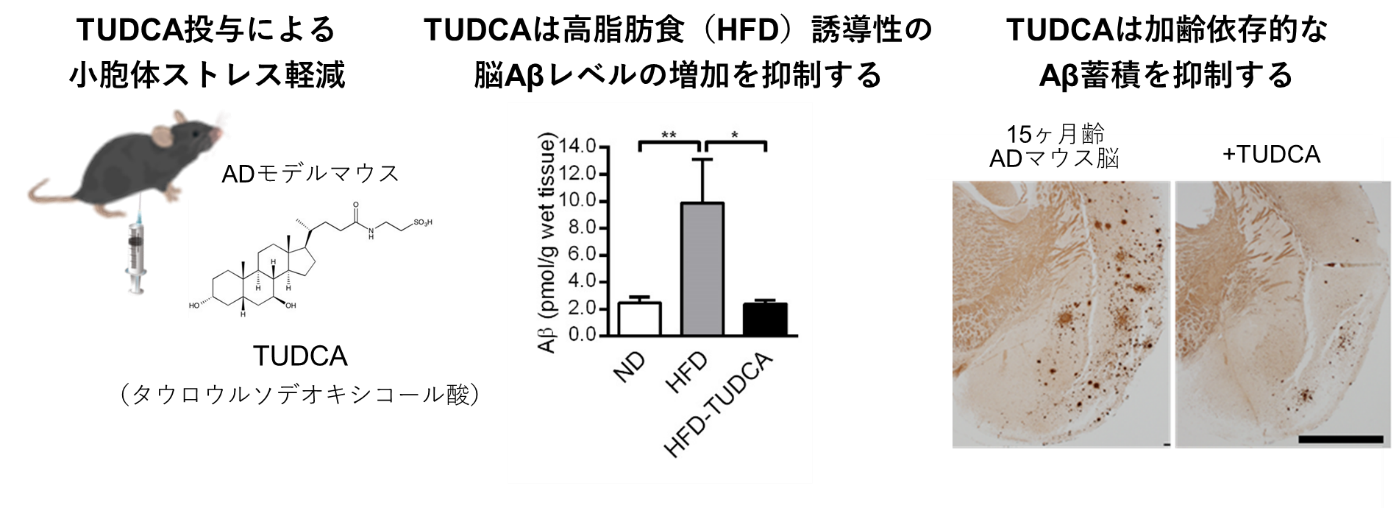
2021年6月17日
新しい論文をJournal of Prevention of Alzheimer's Diseaseに発表しました
Tauroursodeoxycholic Acid Attenuates Diet-Induced and Age-Related Peripheral Endoplasmic Reticulum Stress and Cerebral Amyloid Pathology in a Mouse Model of Alzheimer’s Disease
Toshitaka Ochiai, Takeru Nagayama, Kentaro Matsui, Koichi Amano, Toshiharu Sano, Tomoko Wakabayashi, Takeshi Iwatsubo
J Prev Alzheimers Dis, 8:483-494, 2021, doi: 10.14283/jpad.2021.33
肥満と糖尿病は、アルツハイマー病(AD)の危険因子として確立されています。小胞体ストレスは、肥満や糖尿病におけるインスリン抵抗性や代謝異常の主要な原因の一つとして知られており、その軽減を目的とした介入は全身の代謝異常を改善することが示されています。またAD患者の脳でも小胞体ストレスの亢進が報告されています。本研究では、ADモデルマウスに高脂肪食を与えて肥満・糖尿病を誘発し、ADの病因タンパク質であるAβの蓄積が促進されるモデルを用いました。これに対し、小胞体ストレスを軽減する作用を持つTUDCAを末梢から投与すると、代謝異常の改善とともに、脳のAβ蓄積も抑制されました。一方で、TUDCAを脳内に直接投与しても、Aβ蓄積は抑制されませんでした。更に、通常の餌で飼育し加齢させたマウスにおいても、TUDCAの末梢投与はインスリン抵抗性や代謝異常を改善し、それに伴いAβ蓄積も抑制しました。このことから、末梢組織の小胞体ストレスを標的とした介入は、過食や加齢に伴う脳のAβ病理に対する有益な予防・治療戦略ともなる可能性が考えられます。
論文へのリンクはこちら。
2020年12月7日
新しい論文をActa Neuropathologica Communicationsに発表しました
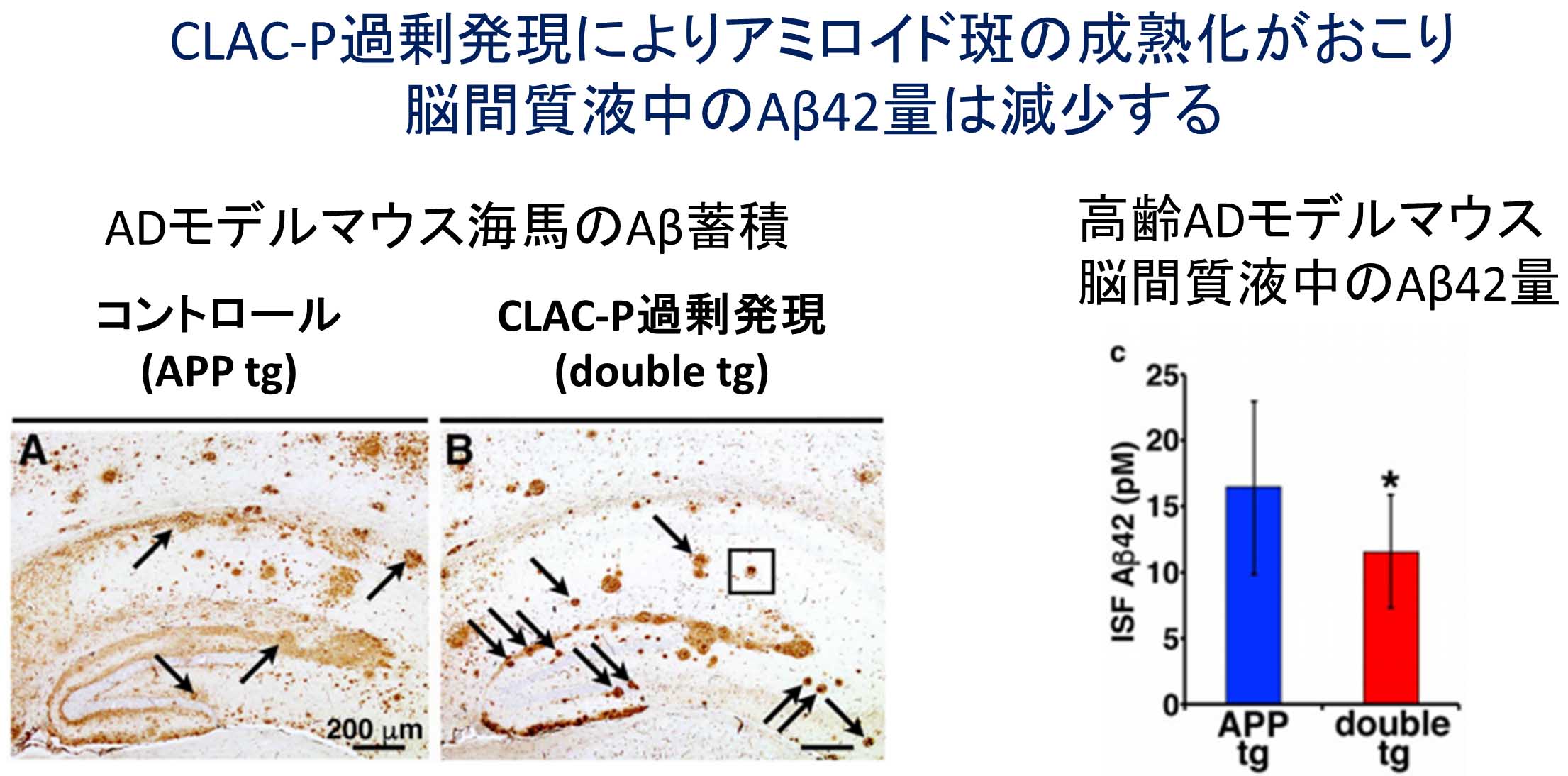
Collagenous Alzheimer amyloid plaque component impacts on the compaction of amyloid‑β plaques
Tadafumi Hashimoto*, Daisuke Fujii*, Yasushi Naka*, Mayu Kashiwagi‑Hakozaki*, Yuko Matsuo, Yusuke Matsuura, Tomoko Wakabayashi and Takeshi Iwatsubo (*co-first author)
Acta Neuropathologica Communications, 2020 Dec 7;8(1):212. doi: 10.1186/s40478-020-01075-5
アルツハイマー病(AD)患者の脳に特徴的な病理学的変化として老人斑があり、老人斑の主成分であるアミロイドβ(Aβ)ペプチドの凝集・蓄積はAD発症の原因と考えられています。当研究室では、これまでに、Aβ以外の老人斑構成タンパク質であるコラーゲン様分子CLACを同定しました(Hashimoto et al., 2002)が、CLACがAD脳においてアミロイド病理形成にどのように寄与しているかは不明でした。今回わたしたちは、加齢とともに脳内Aβ蓄積が起こるADモデルマウスを用いて解析を行い、神経細胞にCLAC前駆体タンパク質(CLAC-P)を過剰発現させると、アミロイド斑の形態がダイナミックに変化し、びまん性のアミロイド斑の減少と、コンパクトで成熟した形状のアミロイド斑の増加が起こることを示しました。また、CLAC-Pの過剰発現により、マウス脳間質液中のAβ量が減少することを示しました。これらの結果から、CLACはアミロイド斑をリモデリングし、脳内のAβ動態を変化させることが示唆されました。CLACはAD病態形成に重要な役割を果たす分子であり、新たな治療標的となりうることが期待されます。
論文へのリンクはこちら。
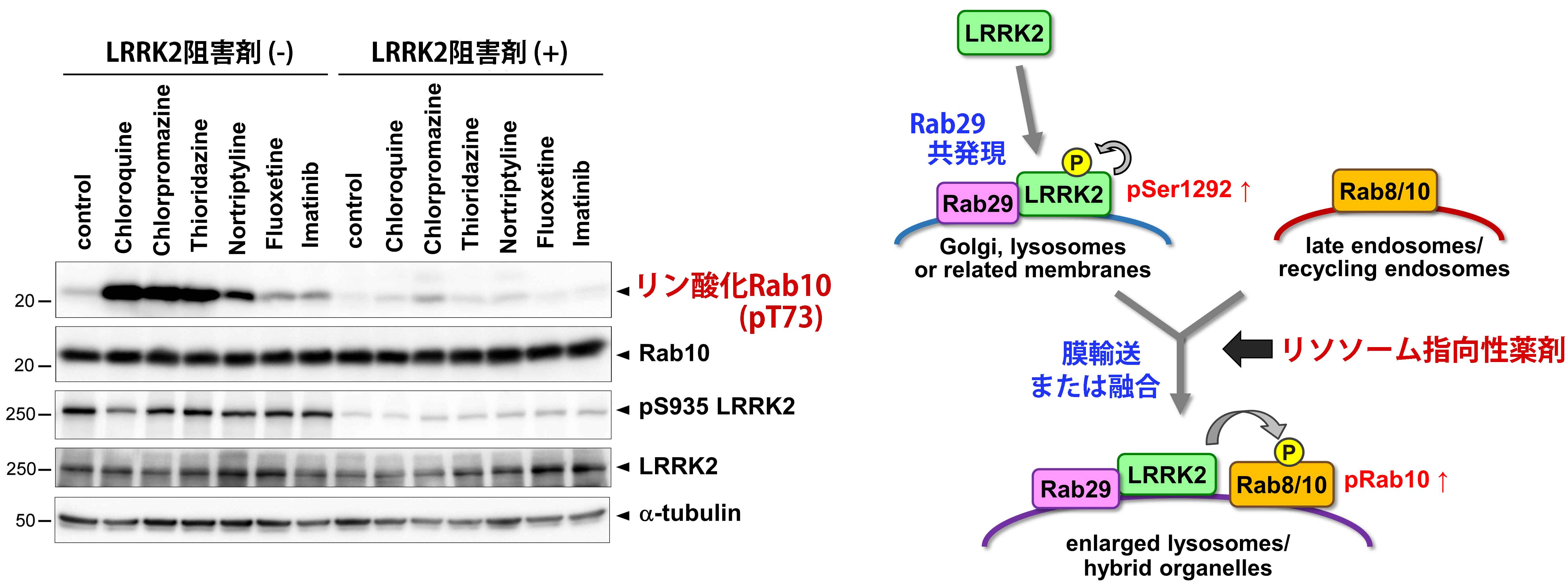
2020年9月10日
新しい論文をNeurobiology of Diseaseに発表しました
Roles of lysosomotropic agents on LRRK2 activation and Rab10 phosphorylation
Tomoki Kuwahara, Kai Funakawa, Tadayuki Komori, Maria Sakurai, Gen Yoshii, Tomoya Eguchi, Mitsunori Fukuda, Takeshi Iwatsubo
Neurobiology of Disease, 2020, doi: 10.1016/j.nbd.2020.105081
Leucine-rich repeat kinase 2 (LRRK2) は優性遺伝性パーキンソン病の主要な病因タンパク質であり、Rab10などの一部のRab GTPaseを細胞内でリン酸化するキナーゼです。LRRK2キナーゼ活性の異常亢進がパーキンソン病発症につながると考えられており、その活性制御機構の解明が求められています。私たちはこれまでに、リソソームストレス誘導剤であるクロロキンを細胞に添加するとLRRK2によるRab10リン酸化が亢進することを報告しました(Eguchi et al, PNAS 2018)。今回私たちは、臨床応用されている薬剤のうち、特定の抗うつ薬や抗がん剤、局所麻酔薬などの薬剤の投与が細胞内においてLRRK2によるRab10リン酸化を顕著に誘導することを見出しました。これらの薬剤はいずれもクロロキンと同様にリソソーム指向性を有していたことから、薬剤の蓄積によるリソソーム過積載がRab10リン酸化をもたらすものと考えられました。また、これらの薬剤の投与はLRRK2の酵素活性自体は上げず、むしろ、LRRK2とRabの近接度を上げることでRab10リン酸化を誘導することが分かりました。一方、薬剤投与によるRab10リン酸化の亢進にはLRRK2活性化因子Rab29が必要であったことから、Rab29と薬剤投与が段階的にRab10リン酸化亢進に寄与するものと考えられました。以上の発見はLRRK2によるRabリン酸化の制御機構に重要な示唆を与えるとともに、LRRK2活性制御に根差したパーキンソン病治療薬の開発に貢献するものと期待されます。
論文へのリンクはこちら。
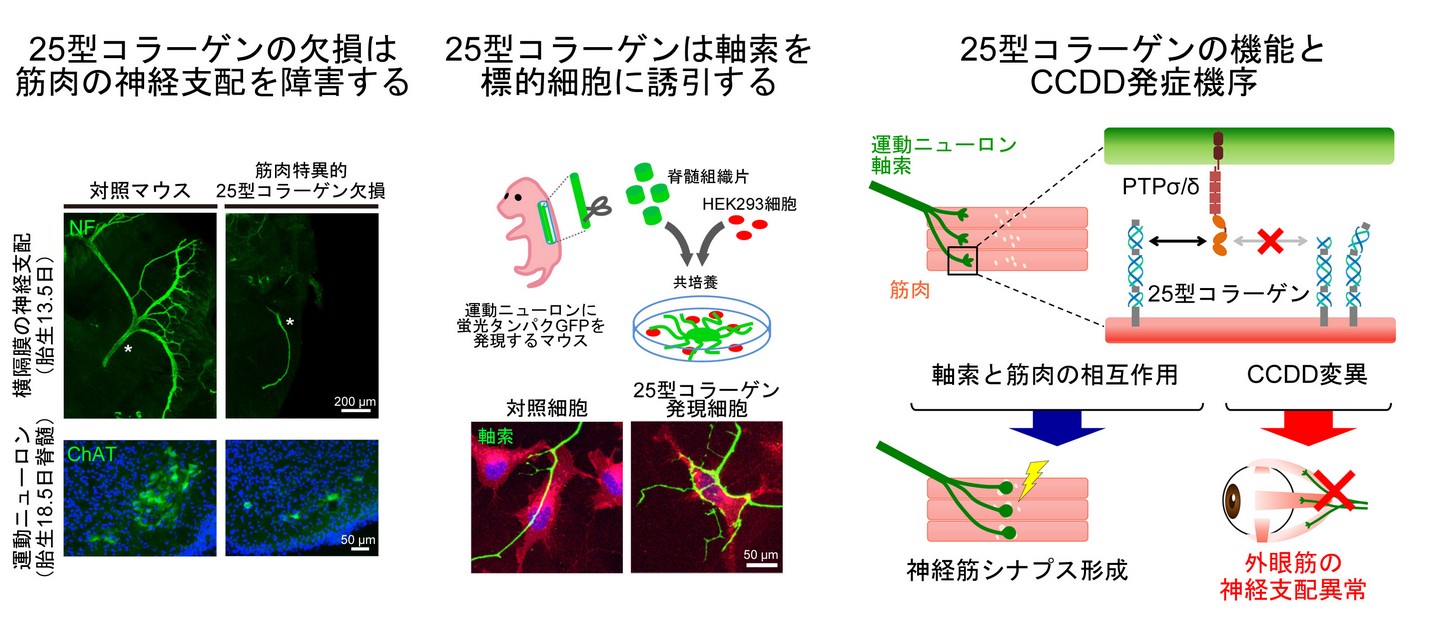
2019年12月25日
新しい論文をCell Reportsに発表しました
筋肉の神経支配に必要な25型コラーゲンの機能を解明
~先天性の脳神経発達異常の病因が明らかに~
Roles of collagen XXV and its putative receptors PTPσ/δ in intramuscular motor innervation and congenital cranial dysinnervation disorder
Haruka Munezane*, Hiroaki Oizumi*, Tomoko Wakabayashi*, Shu Nishio, Tomoko Hirasawa, Takashi Sato, Akihiro Harada, Tomoyuki Yoshida, Takahiro Eguchi, Yuji Yamanashi, Tadafumi Hashimoto, Takeshi Iwatsubo (*co-first author)
Cell Reports on Dec 24, 29(13):4362-4376, 2019, doi: 10.1016/j.celrep.2019.11.112
筋肉の動きを制御する信号は、脊髄の運動ニューロンから伸びる軸索が筋肉との間に形成するシナプス(神経筋接合部)を介して伝達されます。しかし、発生の過程で筋肉に到達した神経が、筋肉に対する直接の支配を促す分子機構は未解明でした。今回私たちは、胎生期の筋肉に発現する25型コラーゲンが、筋肉の神経支配に必須であることを明らかにしました。また、受容体型チロシン脱リン酸化酵素であるPTPσ/δがその結合相手として働くことも見出しました。これまでに、眼球や瞼を動かす外眼筋を支配する運動ニューロンの先天的な発達異常を示す患者さんから、25型コラーゲン遺伝子の変異が見つかっていました。本研究では、それらの変異が25型コラーゲンとPTPσ/δとの結合、ひいては軸索との結合を障害する結果、筋肉の運動神経支配に異常を来すことを明らかにしました。本研究により、25型コラーゲンが、その存在は長らく予想されながらも実体の不明であった筋肉由来の軸索発達促進因子である可能性が示されました。今後は様々な神経筋疾患の発症原理の理解や、治療的応用にもつながってゆくと期待されます。
論文へのリンクはこちら。
東京大学プレスリリース
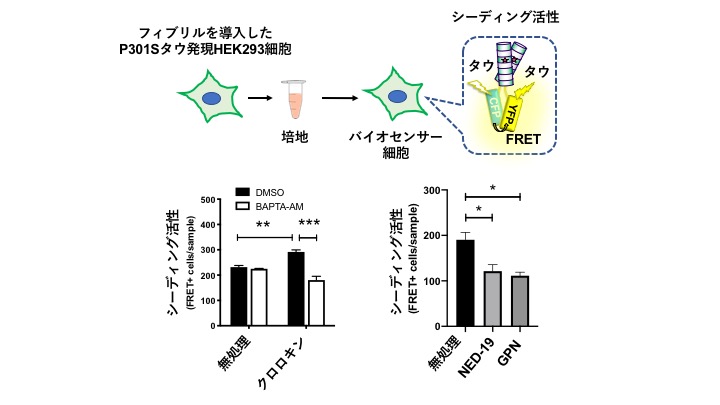
2019年11月8日
新しい論文をFrontiers in Neuroscienceに発表しました
Seeding activity-based detection uncovers the different release mechanisms of seed-competent tau versus inert tau upon lysosomal stress
Yuki Tanaka, Kaoru Yamada, Kyoko Satake, Itaru Nishida, Matthias Heuberger, Tomoki Kuwahara, Takeshi Iwatsubo
Frontiers in Neuroscience, 2019, doi: 10.3389/fnins.2019.01258
アルツハイマー病で神経細胞内に蓄積するタウは、細胞外に放出されることで細胞間を伝播し、その凝集状態が拡がっていくことが知られています。しかしながら、細胞質タンパク質であるタウが、どのような機序で細胞外腔に放出されるのか、そのメカニズムは不明のままでした。今回私たちは、細胞間を伝播するタウの活性をシーディング活性と定義し、その活性を特異的に測定する実験系を利用することで、クロロキン処理などのリソソームストレス依存的にタウの細胞間伝播が亢進することを見出しました。またタウの細胞間伝播はNED-19やGPNで阻害できることから、リソソームエキソサイトーシスがタウの細胞外放出に関与することを明らかにしました。リソソームストレスやリソソームエキソサイトーシスは、伝播に関与しない正常なタウの分泌には影響しなかったことから、本メカニズムを標的とすることで、タウの正常機能を阻害せずにタウの伝播を抑制する治療法の開発が期待できると考えられます。
論文へのリンクはこちら。
2019年4月12日
新しい論文をMolecular Neurodegenerationに発表しました
2型糖尿病におけるインスリン抵抗性がアルツハイマー病脳のアミロイド蓄積を促進するメカニズムを解明
Differential effects of diet- and genetically-induced brain insulin resistance on amyloid pathology in a mouse model of Alzheimer's disease
Tomoko Wakabayashi*, Kazuki Yamaguchi*, Kentaro Matsui*, Toshiharu Sano, Tetsuya Kubota, Tadafumi Hashimoto, Ayako Mano,Kaoru Yamada,Yuko Matsuo, Naoto Kubota, Takashi Kadowaki, and Takeshi Iwatsubo (*co-first author)
Molecular Neurodegeneration on Apr 12, 14(1):15, 2018, doi: 10.1186/s13024-019-0315-7
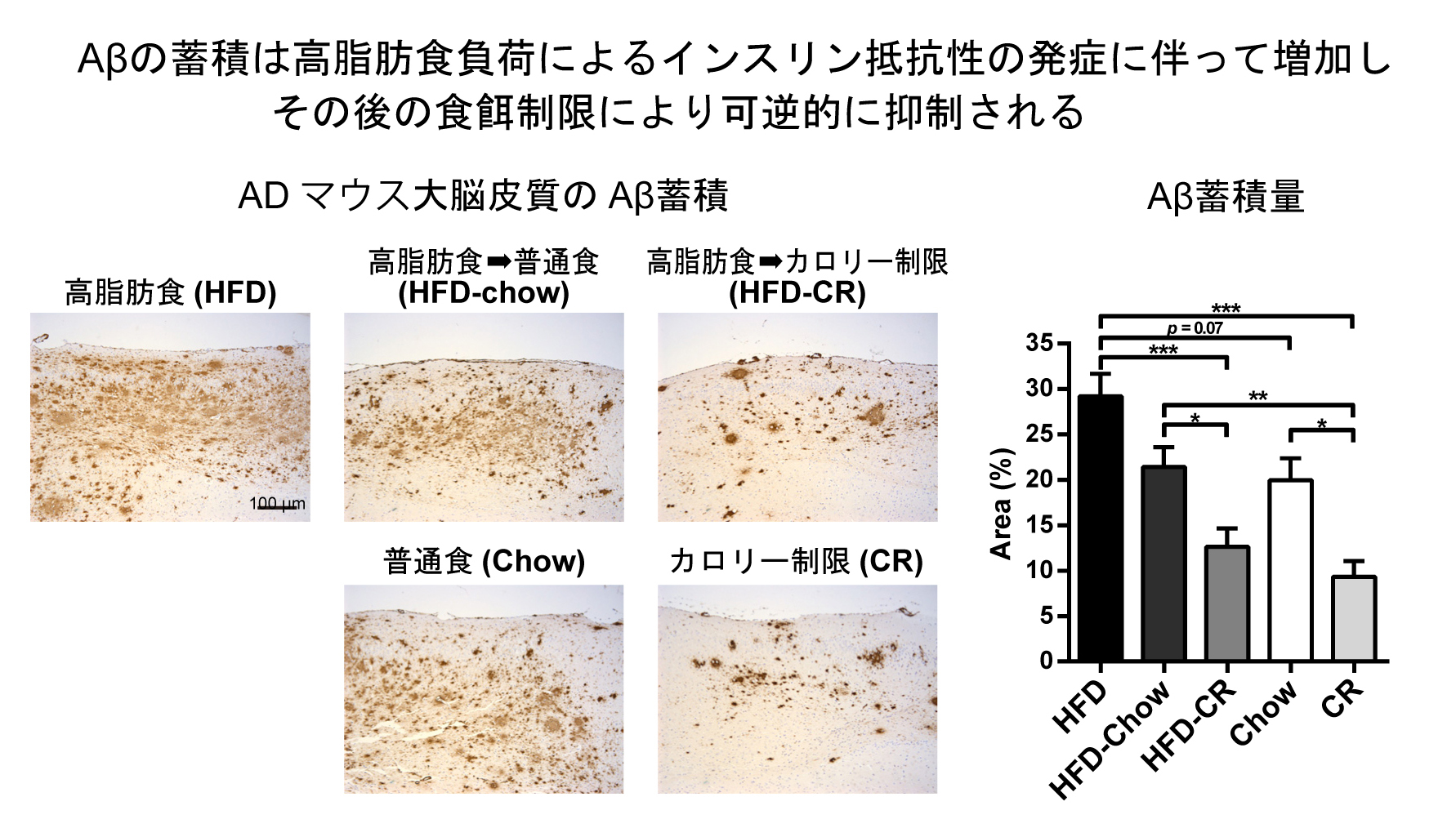
アルツハイマー病(AD)は老年期の認知症として最も頻度の高い疾患です。AD患者の脳に特徴的な病理変化として、アミロイドβペプチド(Aβ)からなる老人斑があり、Aβの蓄積はAD発症の原因であると考えられています。近年、2型糖尿病がAD発症のリスクとなることが明らかになっています。特に、2型糖尿病の中心的な病態であるインスリン抵抗性がADの発症を促す可能性が予測されてきました。しかし、インスリンシグナルの変化とAβの蓄積との因果関係は未解明でした。
我々は、脳にAβの蓄積を生じるADモデルマウスを用い、高脂肪食により誘発されたインスリン抵抗性と、インスリンシグナルの鍵分子であるIRS-2の欠損に伴うインスリン抵抗性による影響を比較、解析しました。その結果、インスリンの作用低下そのものではなく、インスリン抵抗性発症の要因となる代謝ストレスが、Aβの脳内の除去速度を低下させ、結果として蓄積を促進する可能性を示しました。また、食事制限により、脳のAβ蓄積は可逆的に抑制できることを明らかにしました。
2型糖尿病がAD発症のリスクとなることは広く知られてきましたが、本研究はその背後にあるメカニズムの一端を解明し、未だ確立していないADの治療法創出に向け、新たな標的を明らかにしました。本研究は本学医学部附属病院・門脇孝特任教授、窪田直人准教授らとの共同研究により行われました。
論文へのリンクはこちら。
プレスリリース:東京大学、AMED
本研究成果は日本経済新聞、ヘルスデーニュースに掲載されました。
2018年9月13日
新しい論文をProceedings of the National Academy of Sciences of the United States of America (PNAS) に発表しました
パーキンソン病 病因タンパク質LRRK2の関わる新規ストレス応答機構の発見
LRRK2 and its substrate Rab GTPases are sequentially targeted onto stressed lysosomes and maintain their homeostasis
Tomoya Eguchi*, Tomoki Kuwahara*, Maria Sakurai*, Tadayuki Komori, Tetta Fujimoto, Genta Ito, Shin-ichiro Yoshimura, Akihiro Harada, Mitsunori Fukuda, Masato Koike, and Takeshi Iwatsubo (*co-first author)
PNAS published ahead of print September 12, 2018, https://doi.org/10.1073/pnas.1812196115 (open access)
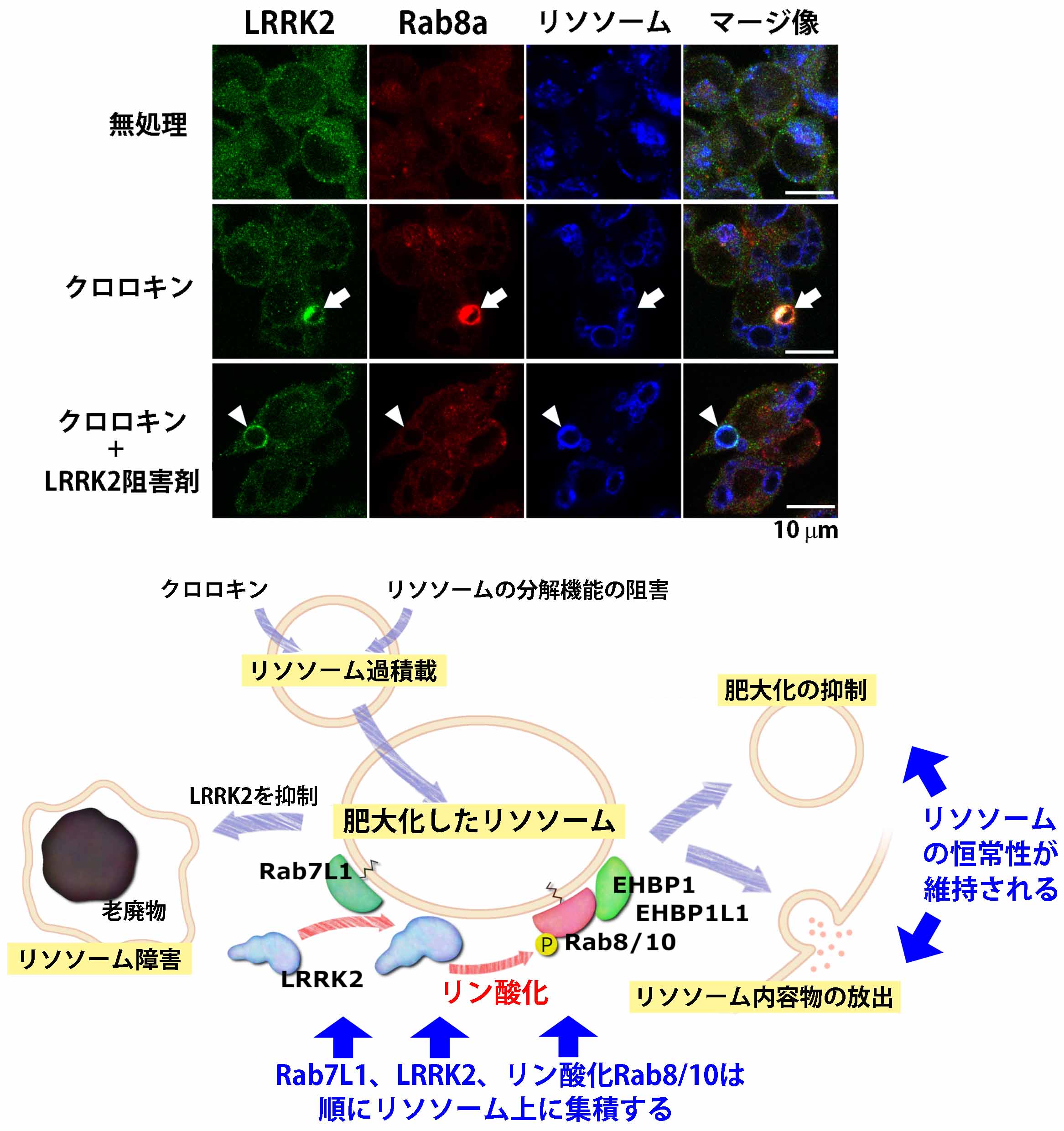
LRRK2(leucine-rich repeat kinase 2)は家族性パーキンソン病の病因遺伝子産物であり、その機能を明らかにすることがパーキンソン病治療法開発の鍵になると考えられます。LRRK2はキナーゼ活性を有し、近年、当研究室を含めた複数のグループから、細胞内における基質として一部のRabファミリー低分子量Gタンパク質(Rab8a, Rab10, Rab7L1など)が報告されました。しかしLRRK2によるRabリン酸化の役割については不明でした。一方、Lrrk2の欠損マウスでは腎臓や肺において肥大したリソソームの蓄積を認めることから、LRRK2とリソソームとの関連が示唆されてきました。今回、私達はLRRK2と基質Rabがリソソームに対するストレスに応答してリソソーム膜上に集積し、リソソームの恒常性を維持することを発見しました。その機構として、リソソームが過積載状態になり肥大化すると、まずRab7L1とLRRK2が順にリソソーム膜上に局在化し、LRRK2のキナーゼ活性が亢進すること、次にRab8aとRab10がLRRK2によるリン酸化を受けてリソソーム膜上に集積し、相互作用因子であるEHBP1とEHBP1L1を動員してリソソームの肥大化抑制とリソソーム内容物の細胞外放出を引き起こすことを明らかにしました。この発見は、リソソームがストレスに応答する新たな機構を提唱するものであると同時に、病因タンパク質の分解障害や細胞外への放出などの、パーキンソン病の病態メカニズムの理解と治療法の開発にもつながるものと期待されます。本研究は、順天堂大学・小池正人教授、東北大学・福田光則教授、大阪大学・原田彰宏教授との共同研究の成果です。
論文へのリンクはこちら。
東京大学からのプレスリリースはこちら。
本研究成果はAlzforum、日経バイオテク、日本経済新聞、日刊工業新聞に掲載されました。
2018年5月10日
新しい論文をAlzheimer's & Dementiaに発表しました
J-ADNI研究によりアルツハイマー病早期段階(軽度認知障害)の進行過程を解明
Japanese and North American Alzheimer’s Disease Neuroimaging Initiative studies: Harmonization for international trials
Takeshi Iwatsubo, Atsushi Iwata, Kazushi Suzuki, Ryoko Ihara, Hiroyuki Arai, Kenji Ishii, Michio Senda, Kengo Ito, Takeshi Ikeuchi, Ryozo Kuwano, Hiroshi Matsuda, Japanese Alzheimer's Disease Neuroimaging Initiative, Chung-Kai Sun, Laurel A. Beckett, Ronald C. Petersen, Michael W. Weiner, Paul S. Aisen, Michael C. Donohue, Alzheimer's Disease Neuroimaging Initiative
Alzheimer’s & Dementia: The Journal of the Alzheimer's Association
Articles In Press, May 9, 2018, doi.org/10.1016/j.jalz.2018.03.009 (open access)
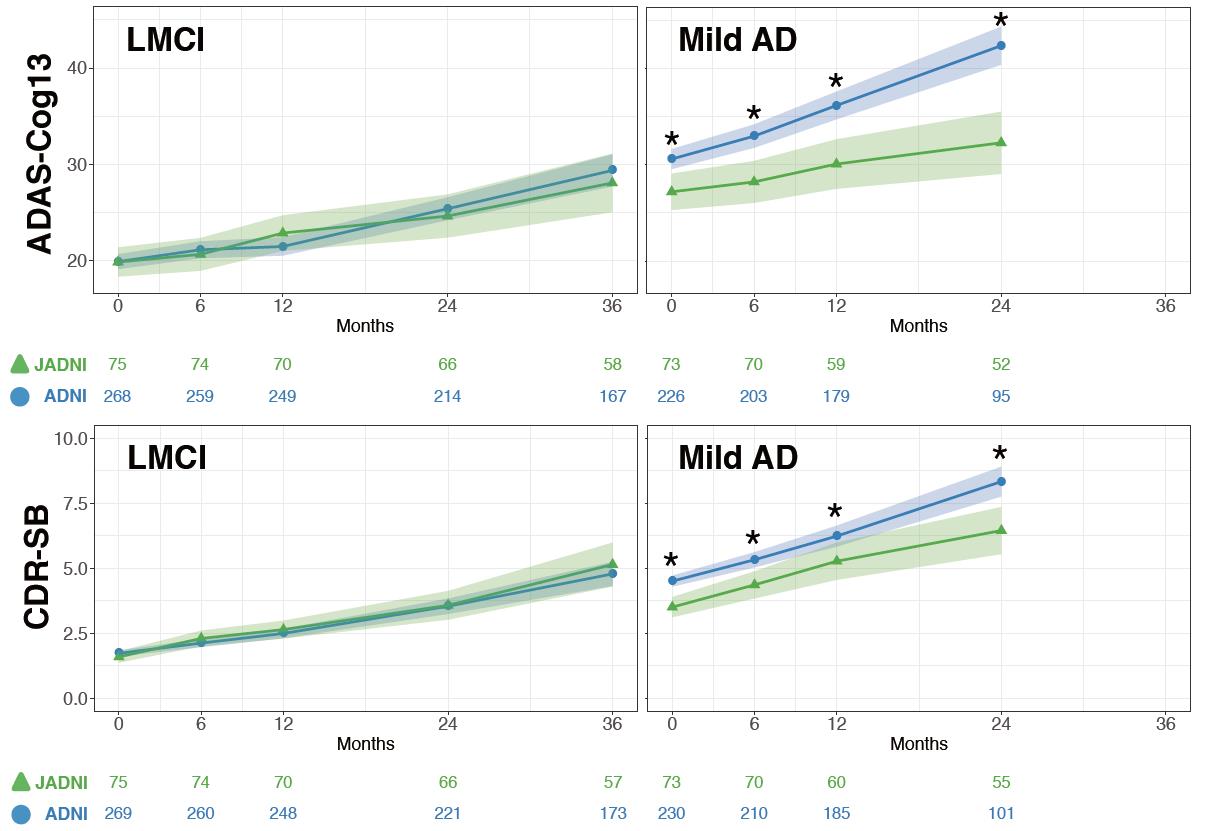
アルツハイマー病(AD)の今後の予防・治療の対象として重要な軽度認知障害(MCI)などの早期段階を、画像診断やバイオマーカーを用いて精密に評価するAlzheimer’s Disease Neuroimaging Initiative (ADNI)研究が米国で進み、本邦でもJ-ADNI研究が推進されてきました。今回、J-ADNIの全結果を詳細に解析することにより、アミロイドPET画像法などの最新技術によって診断された、ADを原因とするMCIについて、その症状や進行速度などの特徴が米国ADNIのMCIに極めて類似していることを明らかにしました。J-ADNI研究では全国で総数537例、うちMCI 234例が3年間にわたり追跡され、今回米国ADNIチームと共同でデータの比較解析が行われました。MCIからADへの進行過程の自然経過に日本人と欧米人で高い共通性が示され、AD根本治療薬(疾患修飾薬)の治験においても、認知症期に比して未だ進行のスピードが遅いMCIなどの早期段階で、治療薬の効果を精密に評価できる技術が確立しました。これによりわが国におけるADの予防・治療薬開発が加速されるものと期待されます。
論文へのリンクはこちら。 J-ADNI Citations (PDF, 60 KB)
プレスリリース:東京大学、AMED
本研究成果はAlzforum、日本経済新聞、読売新聞、朝日新聞に掲載されました。
J-ADNI研究にご参加下さった皆様へのお知らせはこちら (PDF, 973 KB)
2018年2月22日
新しい論文をMolecular Neurodegenerationに発表しました
Extracellular α-synuclein levels are regulated by neuronal activity
Kaoru Yamada, Takeshi Iwatsubo
Molecular Neurodegeneration on Feb 22, 13(1):9, 2018, doi: 10.1186/s13024-018-0241-0
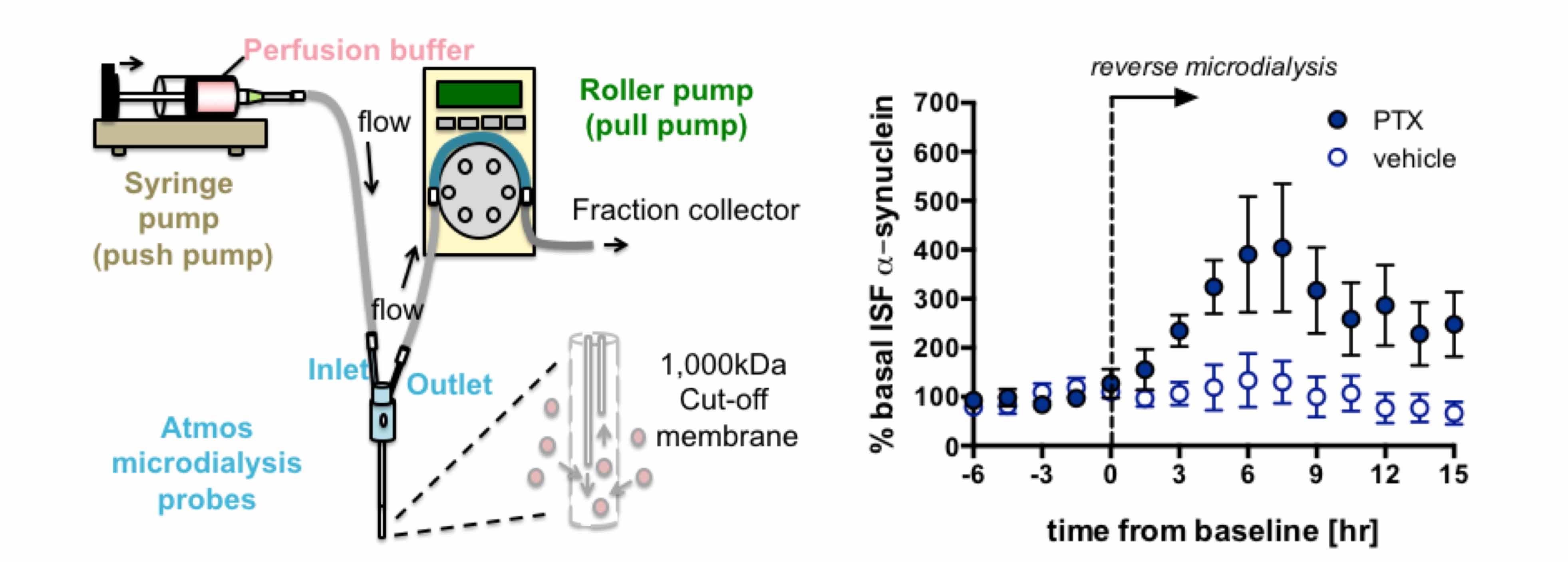
パーキンソン病、レビー小体型認知症で蓄積するα-synucleinは細胞質タンパク質でありながら、細胞外にも分泌されることが知られています。しかしながらシグナル配列を有さないα-synucleinの分泌機構は不明です。私たちは今回、自由行動下のマウスから脳間質液を回収できるin vivo microdialysis法を駆使し、α-synucleinの分泌が神経活動特にグルタミン酸作動性の神経伝達によって制御されていることを見出しました。さらにシナプス小胞の開口放出とα-synuclein分泌が密接に関連することも明らかになりました。また脳間質液中のα-synucleinが単量体とは異なる 60kdaの高分子体として存在していることも分かりました。神経活動依存的にα-synucleinが細胞外へ放出されるという本研究成果は、近年注目されている、細胞外のα-synucleinが持つ生理的・病的意義に新たな示唆を加えるものです。
論文へのリンクはこちら
Alzforumの記事はこちら
2018年2月8日
新しい論文をHuman Molecular Geneticsに発表しました
Self-assembly of FUS through its low-complexity domain contributes to neurodegeneration
Taisei Matsumoto*, Koji Matsukawa*, Naruaki Watanabe, Yuya Kishino, Hayato Kunugi, Ryoko Ihara, Tomoko Wakabayashi, Tadafumi Hashimoto, Takeshi Iwatsubo (*co-first author)
Human Molecular Genetics in press, first published on 7 February 2018, doi: 10.1093/hmg/ddy046
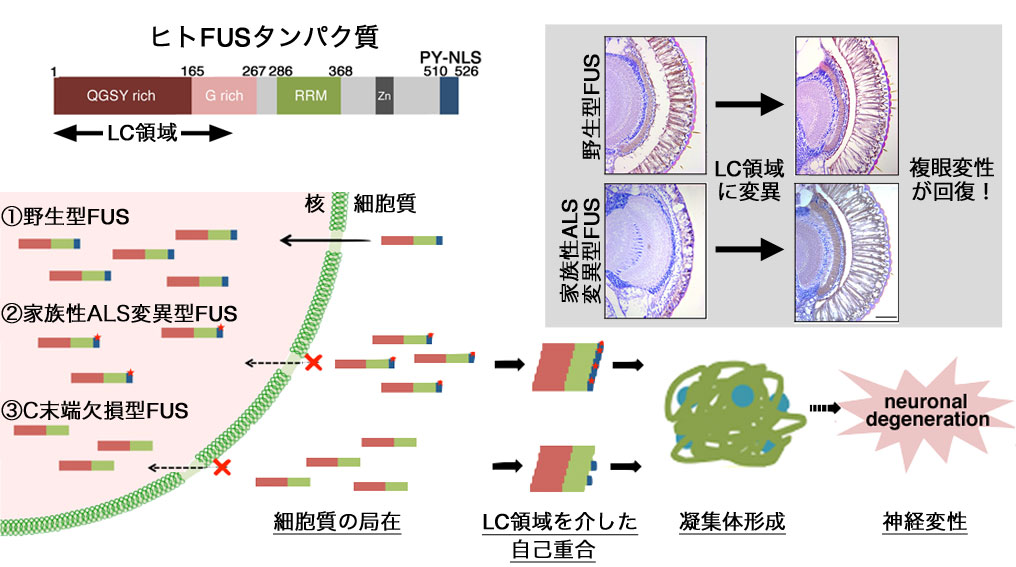
FUSは家族性筋萎縮性側索硬化症 (ALS)の病因遺伝子として、SOD1遺伝子に次いで頻度の高い遺伝子であり、またFUSタンパク質は、家族性及び孤発性ALSの運動ニューロンや、前頭側頭葉型変性症 (FTLD)患者の中枢神経細胞において、細胞内封入体として蓄積することが知られています。しかし、これまでFUSがどのようにALSやFTLDを発症させるか、その機序は未だ不明です。私たちはショウジョウバエの複眼に野生型あるいは家族性ALSを発現させることにより、進行性の神経細胞死を引き起こすモデル動物を作出し、まず、FUSの家族性ALS変異がFUSタンパク質を核内から細胞質へ移行させると共に、神経細胞死を増悪させることを見出しました。さらに、FUSのアミノ末端に存在する、アミノ酸残基の種類が乏しいlow-complexity (LC)領域に注目し、LC領域の27個のチロシン残基を全てセリン残基に変異させたallS変異は、FUS同士の自己重合能を喪失させ、さらに神経細胞死を抑制することを明らかにしました。この結果は、FUSが細胞質においてLC領域を介して自己重合することにより、神経毒性を発揮する可能性を示唆しており、今後ALSやFTLDの病因解明、さらに、重篤な神経難病であるALSの根本治療薬開発に重要な知見を与えるものであります。
論文へのリンクはこちら
2017年12月6日
新しい論文をBiochemical and Biophysical Research Communicationsに発表しました
Parkinson's disease-associated mutant LRRK2 phosphorylates Rab7L1 and modifies trans-Golgi morphology
Tetta Fujimoto*, Tomoki Kuwahara*, Tomoya Eguchi, Maria Sakurai, Tadayuki Komori, Takeshi Iwatsubo (*co-first author)
Biochem Biophys Res Commun in press on Dec 6, 2017, doi: 10.1016/j.bbrc.2017.12.024
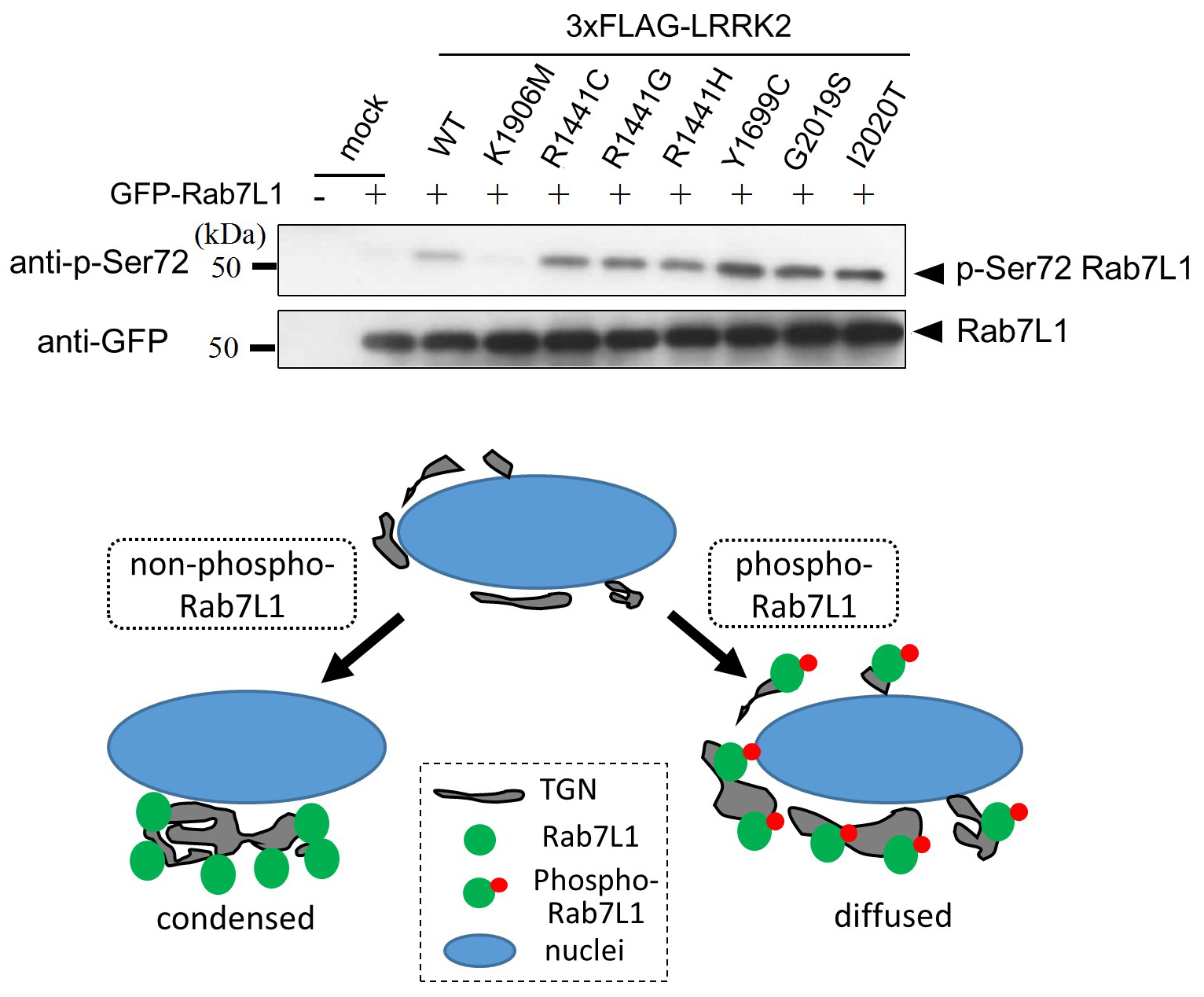
Leucine-rich repeat kinase 2(LRRK2)は晩発性に発症する家族性パーキンソン病の病因遺伝子として最も主要なものであり、その生理的・病的作用の解明が待たれています。私たちはこれまでに、パーキンソン病のリスク遺伝子Rab7L1がLRRK2と相互作用し、様々な生理的機能を調節することを明らかにしてきました。今回、本研究において、キナーゼであるLRRK2がRab7L1を細胞内でリン酸化することを見出しました。興味深いことに、家族性パーキンソン病の原因となる6種類のLRRK2の変異は、いずれもRab7L1のリン酸化を顕著に亢進させることが分かりました。また、リン酸化部位がSer72であること、ゴルジ体に局在するRab7L1がリン酸化を受けることも見出しました。さらに、Rab7L1がリン酸化を受けると、ゴルジ体がより断片化し、細胞質内に広く拡散することも分かりました。ゴルジ体の断片化はパーキンソン病の脳内において観察される病理学的変化であり、Rab7L1の過剰なリン酸化が病態形成につながる可能性を示唆する重要な知見であると考えられます。
論文へのリンクはこちら
2016年9月15日
新しい論文をJournal of Biological Chemistryに発表しました
Familial ALS-linked Mutations in Profilin 1 Exacerbate TDP-43-induced Degeneration in the Retina of Drosophila Melanogaster through an Increase in the Cytoplasmic Localization of TDP-43
Koji Matsukawa, Tadafumi Hashimoto, Taisei Matsumoto, Ryoko Ihara, Takahiro Chihara, Masayuki Miura, Tomoko Wakabayashi, Takeshi Iwatsubo
J Biol Chem 2016 Nov 4; 291(45):23464-23476, doi: 10.1074/jbc.M116.729152
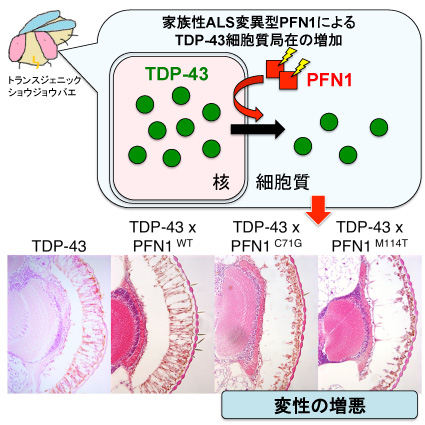
TDP-43は家族性筋萎縮性側索硬化症 (ALS) の病因遺伝子であり、家族性および大多数の孤発性ALS患者の運動ニューロンや、前頭側頭葉変性症 (FTLD) 患者の大脳皮質においてTDP-43タンパク質が神経細胞内に細胞質封入体として蓄積することが知られています。私たちは、これまでにTDP-43をショウジョウバエの複眼に過剰発現するモデル動物を作出し、進行性の複眼変性が導かれることを明らかにしてきました。一方で近年、家族性ALSの新しい病因遺伝子としてProfilin 1 (PFN1) が報告されました。しかし、PFN1がどのようにして神経変性を引き起こすのか、またTDP-43との関連は明らかではありませんでした。本研究では、ショウジョウバエの複眼にTDP-43およびPFN1を過剰発現するモデルを作出し、家族性ALSに連鎖するPFN1の変異がTDP-43による複眼変性を増悪させることを発見しました。さらに、家族性ALS変異型PFN1がTDP-43の細胞内局在を核から細胞質へ移行させることにより、毒性を増悪させていることを見いだしました。この結果は、根本治療法の開発が待たれるALSやFTLDの病因解明に重要な洞察を与えることが期待されます。本研究は、本学大学院薬学系研究科遺伝学教室との共同研究の成果です。
2015年5月1日
新しい論文をCell Reportsに発表しました
アルツハイマー病の病理変化と神経活動の関係を光遺伝学を用いて実証
Chronic optogenetic activation augments Aβ pathology in a mouse model of Alzheimer disease
Kaoru Yamamoto*, Zen-ichi Tanei*, Tadafumi Hashimoto, Tomoko Wakabayashi, Hiroyuki Okuno, Yasushi Naka, Ofer Yizer, Lief E. Fenno, Masashi Fukayama, Haruhiko Bito, John R. Cirrito, David M. Holtzman, Karl Deisseroth, Takeshi Iwatsubo (*co-first author)
Cell Reports 11(6), 12 May 2015, Pages 859-865, doi: 10.1016/j.celrep.2015.04.017
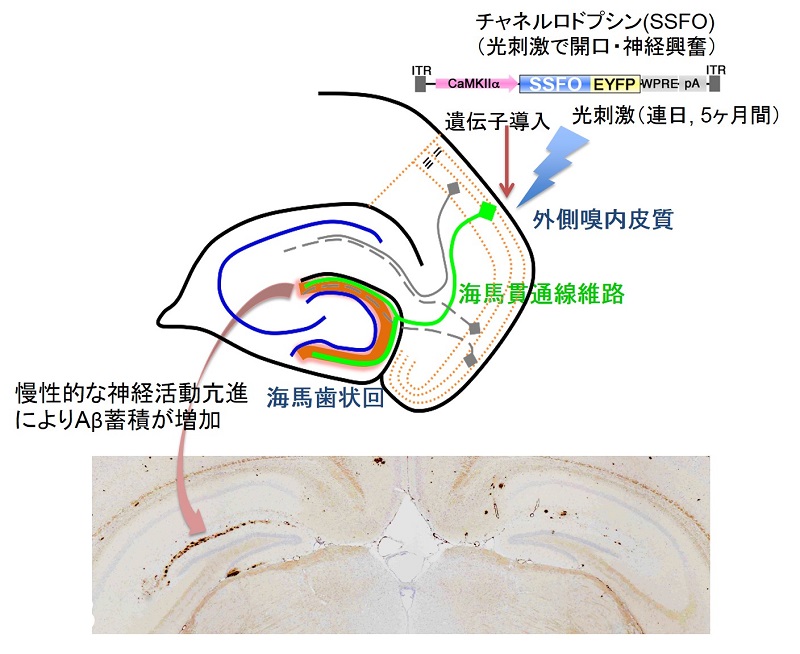
アルツハイマー病の脳では、アミロイドβ(Aβ)と呼ばれるタンパク質の断片が溜まってくることが認知症の症状を招く原因と考えられています。脳の神経細胞はシナプスを介してつながり、電気的な興奮を伝えること(神経活動)により機能を営んでいますが、神経活動とAβの蓄積の関係は十分に分かっていませんでした。本研究では、アルツハイマー病モデルマウスの脳における神経活動を最新の実験手法である光遺伝学により制御し、海馬と呼ばれる重要な脳部位に入る神経経路の活動を5ヶ月間にわたって慢性的に高めると、海馬のAβ蓄積が増加することを発見しました。本研究成果は、アルツハイマー病の原因となるAβの蓄積が、長期間に及ぶ神経活動の亢進によって増大することを初めて示した点で重要です。アルツハイマー病の予防・治療を進める上で、神経活動をどのように整えるのが有効かについて手がかりが得られることも期待されます。本研究は本学医学系研究科神経生化学分野尾藤晴彦教授、スタンフォード大学Karl Deisseroth教授、ワシントン大学David Holtzman教授らとの共同研究で行われました。
なお、本研究成果はUTokyo Researchに掲載されました。
東京大学からのプレスリリースはこちら
2015年4月28日
新しい論文をJournal of Biological Chemistryに発表しました
Role of apolipoprotein E in β-amyloidogenesis: isoform-specific effects on protofibril to fibril conversion of Aβ in vitro and brain Aβ deposition in vivo
Yukiko Hori, Tadafumi Hashimoto, Hidetoshi Nomoto, Bradley T. Hyman, Takeshi Iwatsubo
J Biol Chem in press on April 27, 2015, doi: 10.1074/jbc. M114.622209
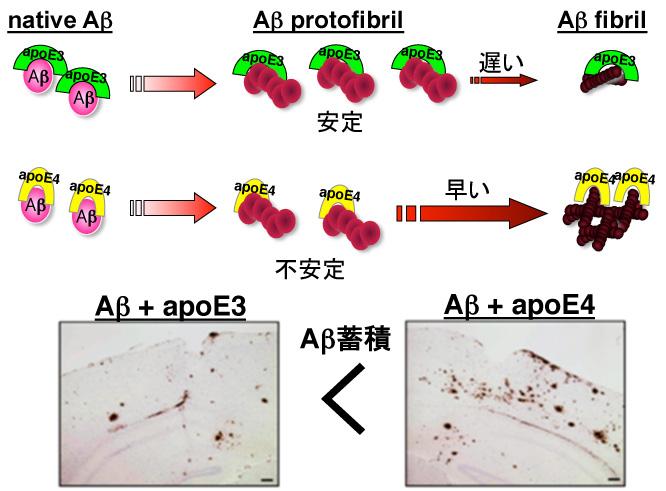
脳内で脂質代謝に関与するapolipoprotein E (apoE)にはε2, ε3, ε4の3つの遺伝多型が存在し、このうち ε4アレルはアルツハイマー病発症の最も強い遺伝的危険因子であることが分かっています。しかし、これまでapoE4がどのようにアルツハイマー病発症に関与するかは不明でした。本論文ではまずアルツハイマー病の病因タンパク質であるamyloid β peptide (Aβ)の凝集過程にapoEがどのように影響を与えるか詳細な検討を行い、apoE2, apoE3はAβの凝集中間体であるAβ protofibrilを安定化させ、その後の線維化を遅らせる作用があるのに対し、apoE4はその作用が乏しいことを見出しました。さらにAβ凝集核をアルツハイマー病モデルマウス脳に注入することによりAβ蓄積を誘導する実験系を用いて検討したところ、Aβ protofibril-apoE3複合体を注入したマウスでは、Aβ protofibril-apoE4複合体を注入したマウスに比べ、Aβ蓄積が減少することを見出し、apoE3にはapoE4に比べAβ蓄積を抑制する効果があることを明らかにしました。これらの結果はapoEがアイソフォーム特異的にAβの凝集・蓄積過程に作用することによってアルツハイマー病発症に関与することを示しており、今後apoEとAβの相互作用を標的とした新たなアルツハイマー病治療薬の開発が期待されます。
2014年5月16日
新しい論文をPLOS ONEに発表しました
Lack of correlation between the kinase activity of LRRK2 harboring kinase-modifying mutations and its phosphorylation at Ser910, 935, and Ser955
Genta Ito*, Tetta Fujimoto*, Shogo Kamikwaji*, Tomoki Kuwahara, Takeshi Iwatsubo (*equal contribution)
PLOS ONE 9(5),e97988 (2014) First Published on May 16, 2013, doi: 10.1371/journal.pone.0097988
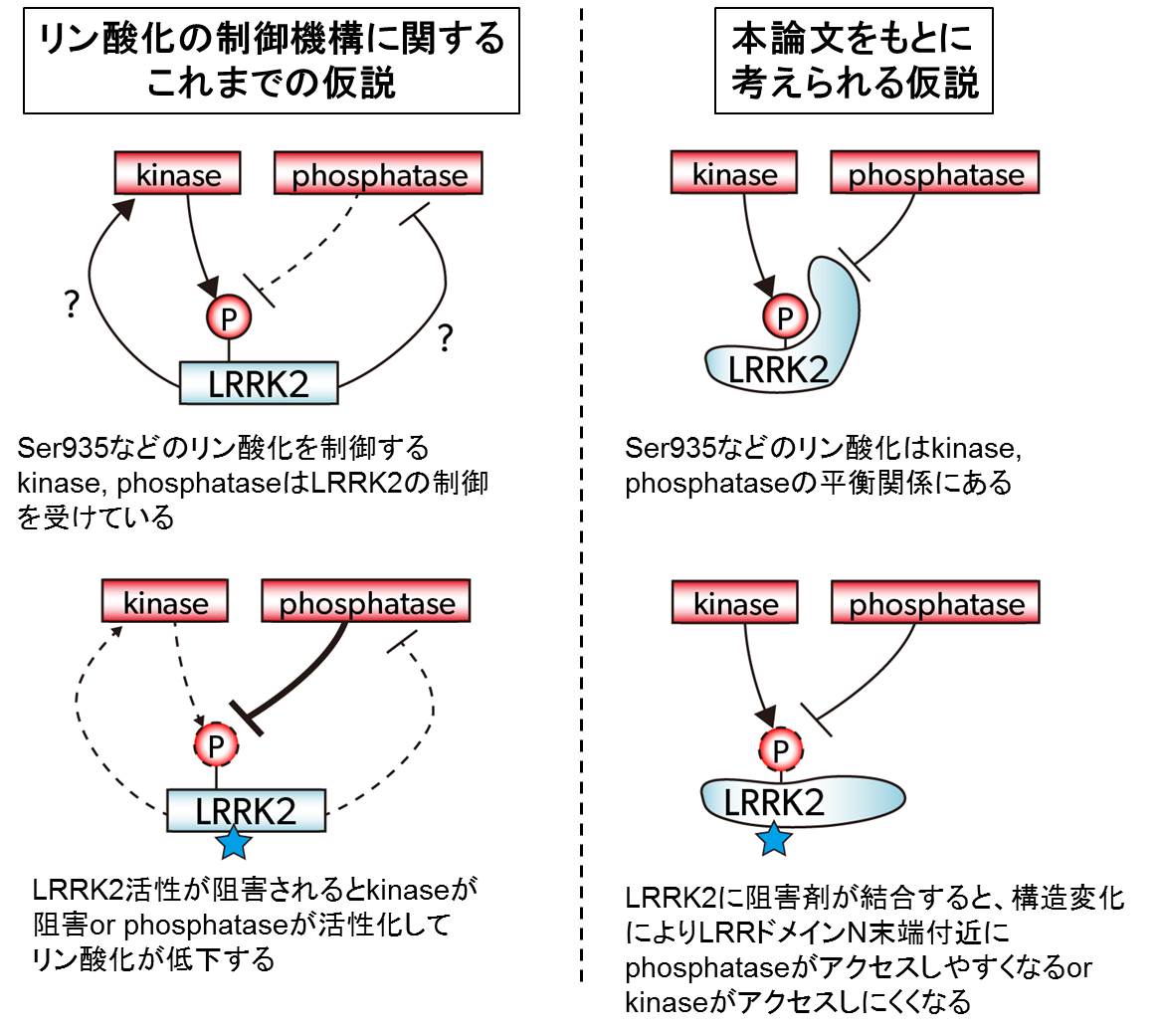
家族性パーキンソン病の責任遺伝子産物のひとつであるLeucine-rich repeat kinase 2(LRRK2)は細胞内の生理的条件下でリン酸化を受けます。LRRK2はキナーゼ活性を有し、細胞をLRRK2阻害剤で処理すると脱リン酸化されることから、LRRK2のリン酸化はLRRK2のキナーゼ活性により制御されていると考えられていました。本論文で、様々な変異体のリン酸化状態および阻害剤による脱リン酸化を解析したところ、キナーゼ活性をもたないT2035A変異体でも野生型LRRK2と同程度のリン酸化が生じ、野生型と同様にLRRK2阻害剤処理時に脱リン酸化されることを見出しました。この結果は、阻害剤処理による脱リン酸化がLRRK2下流シグナルの阻害によるという既存の仮説に反するものです。これらの知見をもとに、阻害剤処理による脱リン酸化の新たなメカニズムを追究することで、LRRK2リン酸化の生理的、病的役割の解明につながることが期待されます。
2014年3月1日
新しい論文をNature Communicationsに発表しました
Decreased CALM expression reduces Aβ42 to total Aβ ratio through clathrin-mediated endocytosis of γ-secretase
Kunihiko Kanatsu, Yuichi Morohashi, Mai Suzuki, Hiromasa Kuroda, Toshio Watanabe, Taisuke Tomita, Takeshi Iwatsubo
Nature Communications 5, Article number: 3386, doi:10.1038/ncomms4386
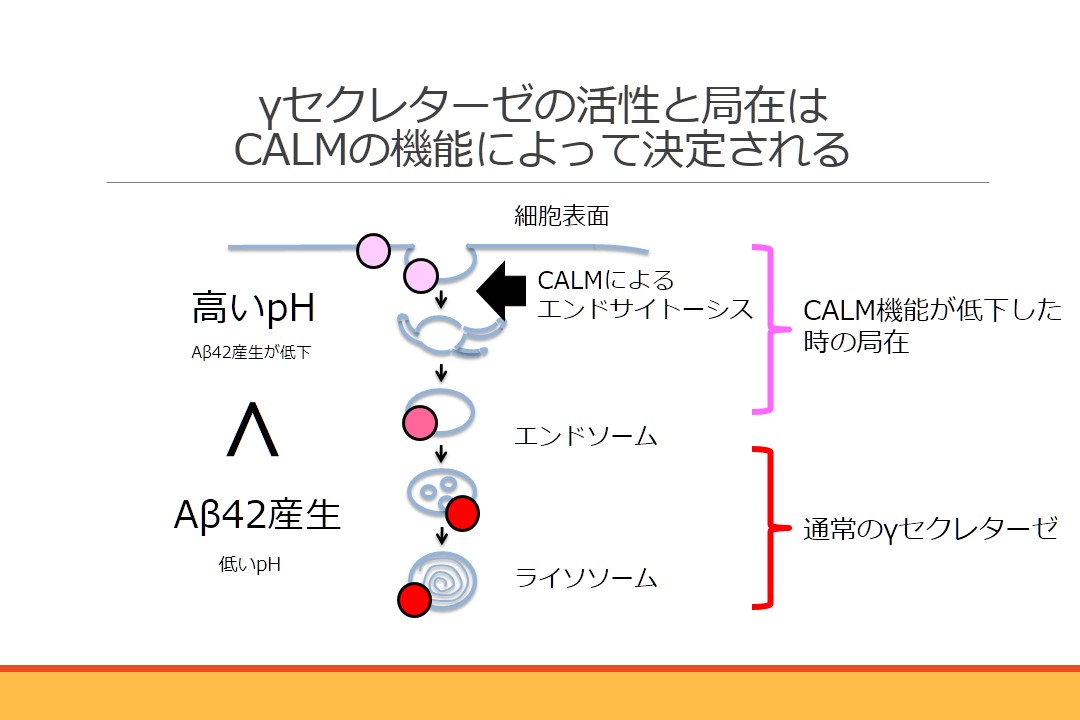
アルツハイマー病の発症予防因子CALM(カルム)タンパク質が、アミロイドβタンパク質産生酵素γセクレターゼの細胞内局在を制御していることを明らかにしました。この酵素の活性はpHによる影響を大きく受け、特に酸性環境下で凝集性の高いAβ42を多く産生することを見出しました。CALMをコードしているPICALM遺伝子近傍に存在する一塩基多型がアルツハイマー病発症リスクを13%低下させることが知られており、本研究成果から予防アレルを持つ人ではAβ42産生が抑制されて可能性が示唆されました。今後、CALMの機能のみを抑制する方法を明らかにすることにより、アルツハイマー病の予防法の開発につながる他、PICALM遺伝子多型によるリスク評価とテーラーメード医療につながることが期待されます。 本研究奈良女子大学大学院人間文化研究科 渡邊利雄教授との共同研究の成果です。
2014年1月23日
新しい論文をJournal of Neuroscienceに発表しました
CLAC-P/Collagen Type XXV Is Required for the Intramuscular Innervation of Motoneurons during Neuromuscular Development
Tomohiro Tanaka, Tomoko Wakabayashi, Hiroaki Oizumi, Shu Nishio, Takashi Sato, Akihiro Harada, Daisuke Fujii, Yuko Matsuo, Tadafumi Hashimoto, Takeshi Iwatsubo
The Journal of Neuroscience, 34(4): 1370-1379
First Published on Jan 22 2014,doi:10.1523/JNEUROSCI.2440-13.2014
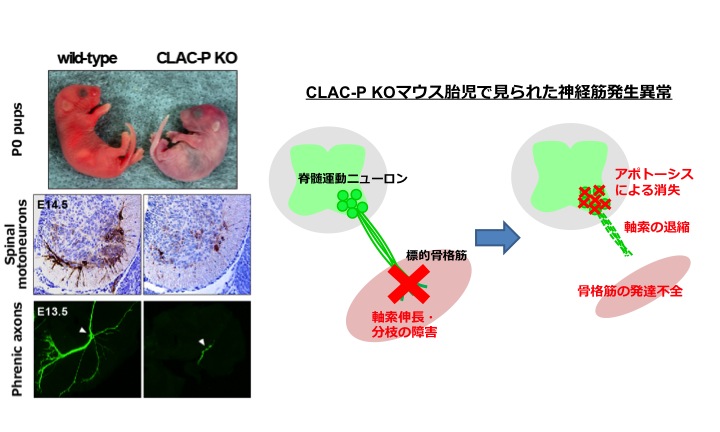
当グループで同定したアルツハイマー病脳の老人斑アミロイドの構成タンパク質であるCLAC-P/collagen XXVについて、今回、胎児の神経筋システムの発生に必須の分子であることを明らかにしました。CLAC-Pを欠損した遺伝子改変マウスの胎児では、脊髄の運動ニューロンが標的骨格筋まで軸索束を投射するものの、筋内での軸索伸長・分枝が起こらず、アポトーシスにより消失すること、またその結果マウスは致死となることを見出しました。運動ニューロンの発生に関わる分子の欠損でこのような広範で顕著な表現型を示す例は稀であり、本研究は神経筋発生の分野に新たな示唆を与えると考えられます。今後、CLAC-Pによる神経-筋肉間相互作用の分子メカニズムの詳細が明らかになることが期待されます。
2014年1月11日
新しい論文をMolecular Neurodegenerationに発表しました
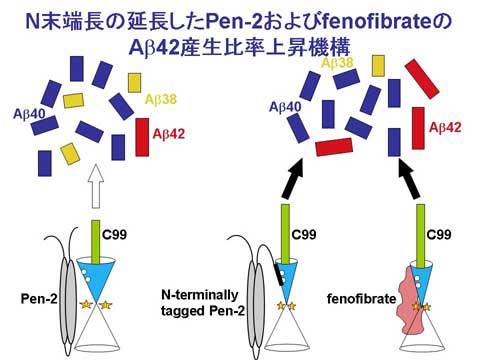
Binding of longer Aβ to transmembrane domain 1 of presenilin 1 impacts on Aβ42 generation
Yu Ohki, Naoaki Shimada, Aya Tominaga, Satoko Osawa, Takuya Higo, Satoshi Yokoshima, Tohru Fukuyama, Taisuke Tomita, Takeshi Iwatsubo
Molecular Neurodegeneration 9(1):7, 2014
γセクレターゼの活性中心サブユニットプレセニリンがどのようにしてAβのC末端長を決定しているかについては明らかになっていません。私達は2011年にAβ42産生を変化させるGSM-1がプレセニリンの第一膜貫通領域に結合することを報告しました(Ohki et al., EMBO J 2011)。今回、異なる構造を持ちAβ42産生を上昇させる低分子化合物Fenofibrateも第一膜貫通領域に結合することを見出しました。そしてこの領域と、APP切断中間産物である「長いAβ」の選択的な結合が、Aβ42産生量に影響を与えることを明らかにしました。本研究はγセクレターゼによる膜内配列切断機構の解明につながると同時に、プレセニリンの第一膜貫通領域がアルツハイマー病治療薬候補であるGSMの創薬標的領域となりうることを示しています。本研究は本学大学院薬学系研究科天然物合成化学教室(現、名古屋大学大学院創薬科学研究科)との共同研究の成果です。
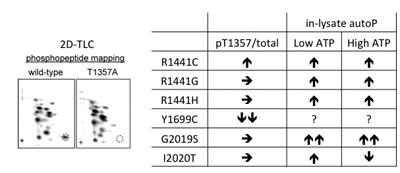
2013年8月8日
新しい論文をBiochemistryに発表しました
Shogo Kamikawaji*, Genta Ito*, Tomoko Sano, and Takeshi Iwatsubo(*equal contribution)
Biochemistry 52(35): 6052-6062, 2013
First Published on August 8, 2013, doi: 10.1021/bi400596m
Leucine-rich repeat kinase 2(LRRK2)は家族性パーキンソン病(FPD; PARK8)の病因遺伝子産物です。現在までに、R1441C/G/H、Y1699C、G2019S、I2020Tの6種類のアミノ酸置換がPARK8の原因となることが知られていますが、そのメカニズムはよくわかっていません。今回私たちは、2次元薄層クロマトグラフィーによるホスホペプチドマッピングを行い、LRRK2の主要な自己リン酸化部位としてThr1348、Thr1349、Thr1357を同定しました。また、Y1699C変異によりThr1357における自己リン酸化が選択的に抑制されること、低濃度のATP存在下において、解析対象外のY1699C変異体を除くすべての変異体が野生型に比して高い自己リン酸化能を発揮することを発見しました。これらの結果から、細胞内ATP濃度が異常に低下した条件下では、FPD変異型LRRK2は野生型LRRK2より高いキナーゼ活性を発揮する可能性が示唆されました。そのような条件下で過剰リン酸化される基質タンパク質の探索から、FPD変異型LRRK2が神経変性を引き起こす分子メカニズムの解明につながる重要な知見です。
2013年6月25日
新しい論文をHuman Molecular Geneticsに発表しました
RNA binding mediates neurotoxicity in the transgenic Drosophila model of TDP-43 proteinopathy
Ryoko Ihara, Koji Matsukawa, Yusei Nagata, Hayato Kunugi, Shoji Tsuji, Takahiro Chihara, Erina Kuranaga, Masayuki Miura, Tomoko Wakabayashi, Tadafumi Hashimoto and Takeshi Iwatsubo
Human Molecular Genetics 22(22):4474-4484, 2013
First Published on June 25, 2013, doi: 10.1093/hmg/ddt296
TDP-43は家族性筋萎縮性側索硬化症(ALS)の病因遺伝子であり、家族性及び孤発性ALS患者の運動ニューロンや、前頭側頭葉型変性症(FTLD)患者の大脳皮質において、細胞内封入体として蓄積することが知られています。しかし、これまでどのようにしてTDP-43が神経変性を引き起こすか不明でした。私たちはショウジョウバエの複眼や運動ニューロンにTDP-43を過剰発現させることにより、進行性の神経細胞死を引き起こすモデル動物を作出し、家族性ALSに連鎖するTDP-43の変異や、TDP-43を細胞質に局在させる変異は神経細胞変性を増悪させることを見出しました。さらに、TDP-43はDNA/RNA結合タンパク質であることから、TDP-43のRNA結合能と神経細胞死との関わりを検討したところ、RNA結合能を失ったTDP-43は神経細胞死を引き起こさないことを発見しました。これらの結果は、TDP-43がRNA結合を介して神経細胞死を引き起こすことを示すものであり、神経難病であるALSやFTLDの病因解明、根本治療薬開発に重要な手がかりを与えると期待されます。本研究は本学大学院医学系研究科神経内科学教室、薬学系研究科遺伝学教室との共同研究の成果です。
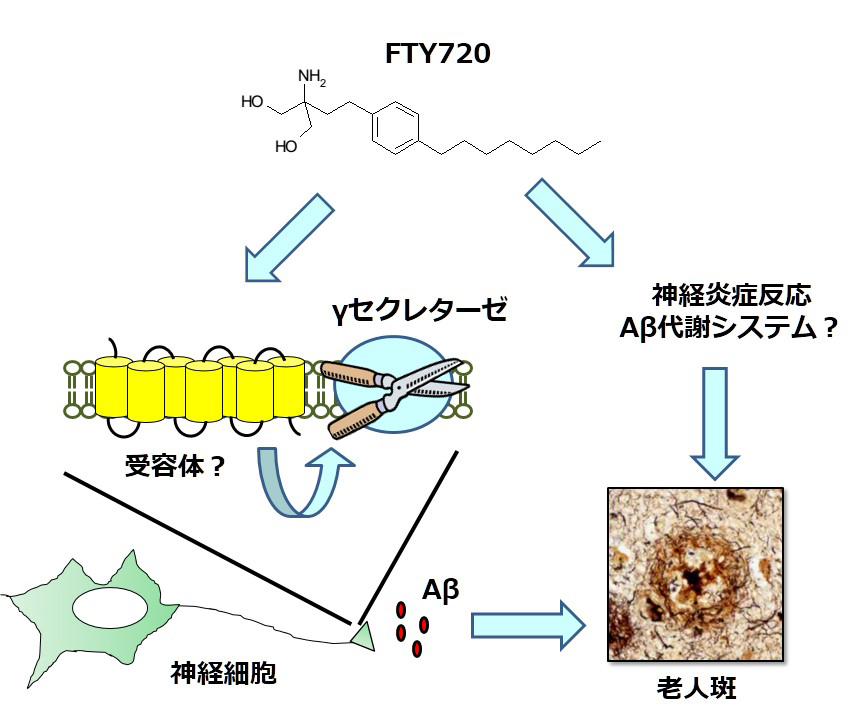
2013年5月7日
新しい論文をPLoS Oneに発表しました
FTY720/Fingolimod, a Sphingosine Analogue, Reduces Amyloid-β Production in Neurons
Nobumasa Takasugi, Tomoki Sasaki, Ihori Ebinuma, Satoko Osawa, Hayato Isshiki, Koji Takeo, Taisuke Tomita, Takeshi Iwatsubo
PLoS ONE 8(5): e64050 (2013)
First Published on May 7, 2013, doi: 10.1371/journal.pone.0064050
スフィンゴシン1リン酸受容体に対する機能性アンタゴニストであるFY720はフィンゴリモドとして多発性硬化症治療薬として使用されている免疫抑制剤です。私たちはこのFTY720が培養神経細胞においてγセクレターゼ活性を抑制し、Aβ産生を抑制することを見出しました。またその分子機構として、既知のスフィンゴシン1リン酸受容体を介したシグナル伝達機構とは異なることも明らかとなりました。一方、ADモデルマウスに6日間投与した場合、脳内Aβ40量が低下するにもかかわらず、脳内Aβ42量は増加するということが明らかになりました。免疫抑制剤としてのFTY720の薬効を考慮すると、これらの結果はFTY720がAβ産生機構のみならず、神経炎症システムを変化させることで脳内Aβ量を制御しうる可能性を示唆しています。今後さらに詳細な解析を行うことで、新しい脳内Aβレベルの制御方法の開発につながることが期待されます。
2012年12月4日
新しい論文をBiochemistryに発表しました
Shizuka Takagi-Niidome, Satoko Osawa, Taisuke Tomita, Takeshi Iwatsubo
Biochemistry 52(1):61-69 (2013)
First Published on December 4, 2012, doi: 10.1021/bi301252r
プレセニリン(PS)はアルツハイマー病発症にかかわるアミロイドβタンパク質の産生や、幹細胞の維持にかかわるNotchを切断する酵素γセクレターゼの活性中心サブユニットです。私たちはこれまでにシステイン残基の特異的化学反応性を利用してPSの構造活性相関を明らかにしてきました。今回、構造生物学的情報に基づいたγセクレターゼ活性制御法のラショナルデザインを目指し、PS1のループ領域に対する特異的抗体9D11を作出しました。そして9D11がγセクレターゼ活性に対する機能阻害抗体として働き、アミロイドβ蛋白の産生を抑制する他、γセクレターゼ活性依存性に増殖を示すがん細胞の生存を抑制することを見出しました。9D11は世界で初めて開発に成功したPSに対する阻害抗体であり、特に第一膜貫通領域のダイナミックなモーションがγセクレターゼの基質切断機構に重要という我々の以前の知見を確認できたものです(Takagi et al., J Neurosci 2010)。これらの情報は、構造情報に基づいたγセクレターゼを標的とする治療薬の開発において重要な知見であると考えられます。
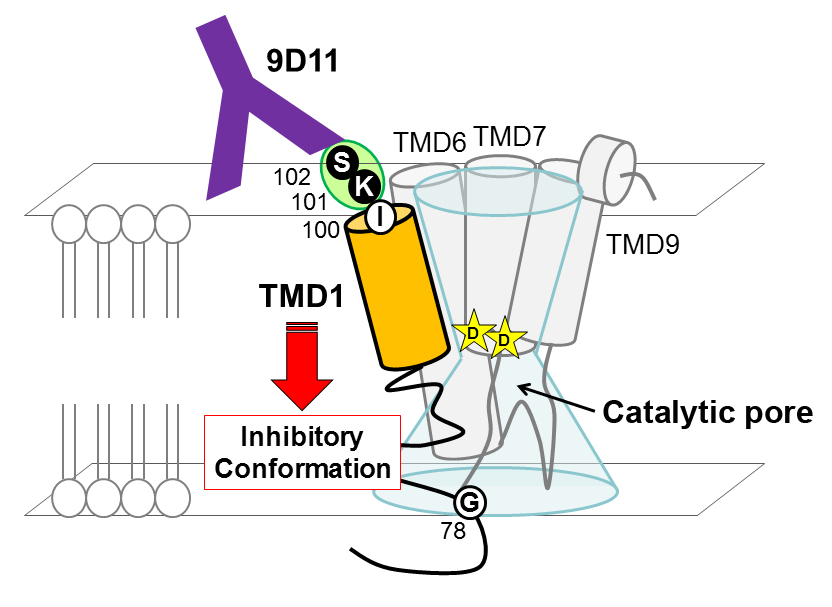
2012年10月18日
新しい論文をNeuronに発表しました
Activity-Dependent Proteolytic Cleavage of Neuroligin-1
Kunimichi Suzuki, Yukari Hayashi, Soichiro Nakahara, Hiroshi Kumazaki, Johannes Prox, Keisuke Horiuchi, Mingshuo Zeng, Shun Tanimura, Yoshitake Nishiyama, Satoko Osawa, Atsuko Sehara-Fujisawa, Paul Saftig, Satoshi Yokoshima, Tohru Fukuyama, Norio Matsuki, Ryuta Koyama, Taisuke Tomita, Takeshi Iwatsubo
Neuron 76(2):410-422 (2012)
First Published on October 18, 2012, doi: 10.1016/j.neuron.2012.10.003
シナプスは神経活動に応じて結合様式や形を変えることが知られています。シナプス形成の異常は自閉症などの精神性疾患の原因となることが知られており、現在、シナプス形成に関わる分子の特定が盛んに行われています。しかし、いまだ不明の点が多く、特に、神経活動からシナプス形成までの一連の流れについてはほとんど調べられていませんでした。我々は、興奮性シナプス形成に必須の分子であり、自閉症の発症と関連が示されているシナプス膜タンパク質Neuroliginに着目しました。そして、まず興奮性の神経活動によって、タンパク質切断酵素であるプロテアーゼが活性化しNeuroliginが切断を受けること、その結果Neuroliginの量が減少して、神経細胞シナプス形成が制御されるという一連の流れを見出しました。また切断現象の責任プロテアーゼとしてADAM10とγセクレターゼの関与を明らかにしました。 本研究成果は、プロテアーゼによる、シナプス膜タンパク質切断がシナプスの形成と機能を制御している可能性を示した点で重要です。シナプス形成に関わる分子自体が、そもそもどのように制御を受けているのかを調べ、神経活動からシナプス形成までの全体像を初めて明らかにした成果です。今後、シナプス形成に関わる分子ではなく、その量を決めるプロテアーゼが、自閉症治療薬開発の重要な創薬標的分子となりうることも示唆されます。
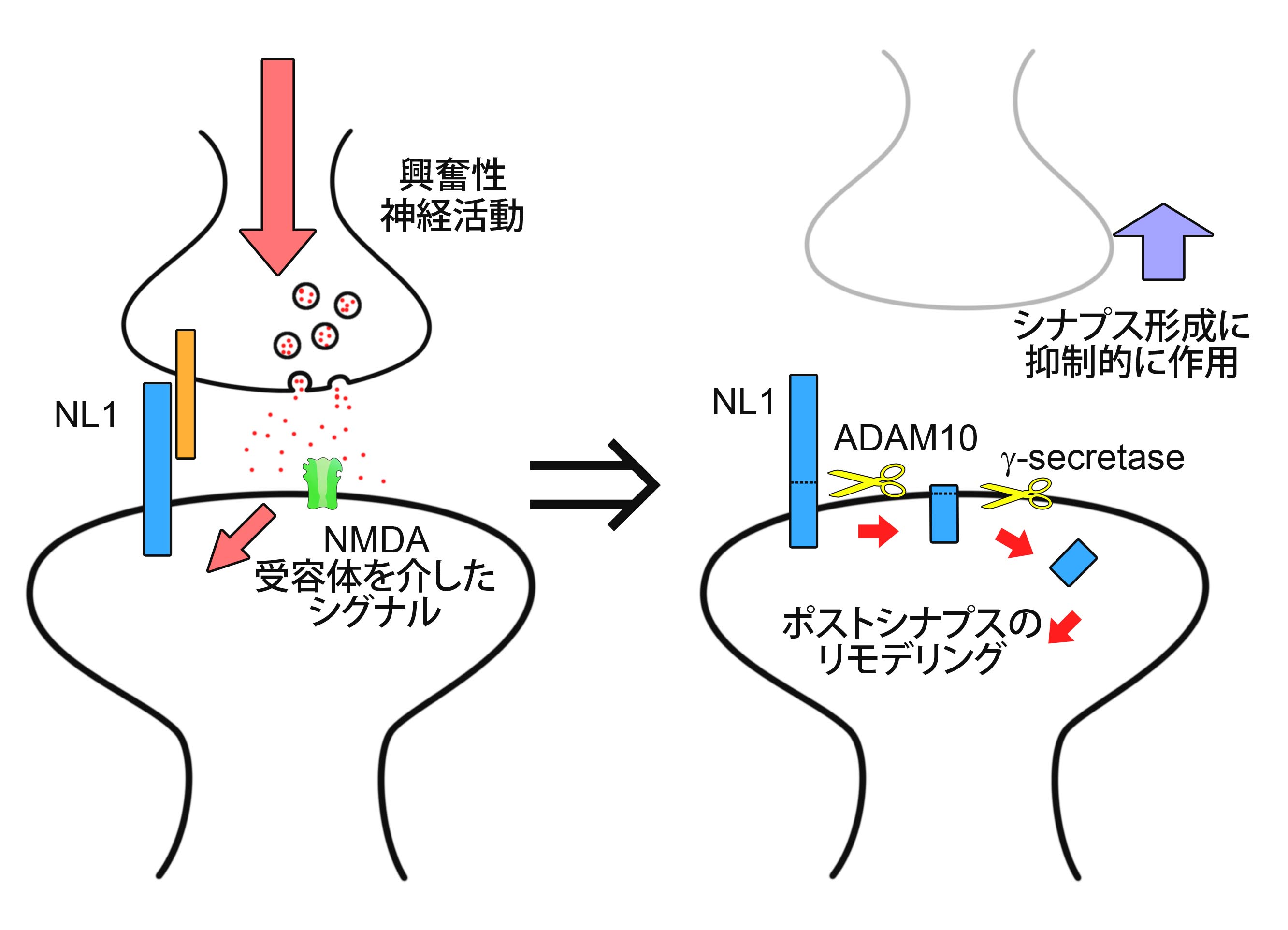
2012年6月11日
新しい論文をThe Journal of Biological Chemistryに発表しました
Contribution of the γ-secretase subunits to the formation of catalytic pore of presenilin 1
Koji Takeo, Naoto Watanabe, Taisuke Tomita and Takeshi Iwatsubo
The Journal of Biological Chemistry 287(31):25834-25843 (2012)
First Published on June 11, 2012, doi: 10.1074/jbc.M111.336347
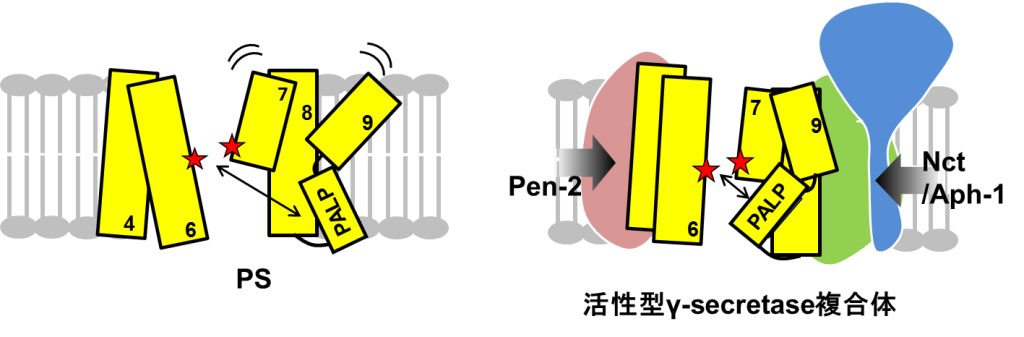
γセクレターゼはアルツハイマー病発症にかかわるアミロイドβタンパク質の前駆体を切断する酵素です。この切断酵素はプレセニリン(PS)、ニカストリン、Aph-1、Pen-2の4つのサブユニットで構成される膜蛋白複合体ですが、活性中心ポア構造がどのように形成されるかについては分かっていませんでした。今回我々はPSの活性中心ポアの構造が他のサブユニットによって制御されている様子を世界で初めて解明しました(スキーム)。サブユニットの結合によって、PSの活性中心ポア構造内のアミノ酸残基に対する水分子のaccessibilityが減少すること、および各アミノ酸残基間の距離が短くなることを発見し、活性中心ポア構造が空間的に限定されることを示しました。これらの情報は、γセクレターゼを標的とする治療薬の開発において重要な知見であると考えられます。
2012年1月9日
新しい論文をThe Journal of Biological Chemistryに発表しました
Tomoki Kuwahara, Reina Tonegawa, Genta Ito, Shohei Mitani and Takeshi Iwatsubo
The Journal of Biological Chemistry 287(10):7098-7109 (2012)
First Published on January 9, 2012, doi: 10.1074/jbc.M111.237131
近年、無脊椎動物である線虫C.elegansの神経系がパーキンソン病における神経変性のモデルになりうることが示唆されています。私達は代表的な家族性パーキンソン病病因遺伝子であるαシヌクレインおよび各種変異体を神経系に発現させた線虫を用いて、パーキンソン病脳内で特徴的なαシヌクレインのセリン129位リン酸化の役割について解析しました。その結果、αシヌクレインのリン酸化は自身の膜結合性を低下させることにより、神経保護的に働く役割を持つことを見出しました。本知見はαシヌクレインリン酸化をターゲットとした創薬を指向する上で重要な足がかりになるものと期待されます。本研究は東京女子医科大学三谷昌平教授との共同研究成果です。
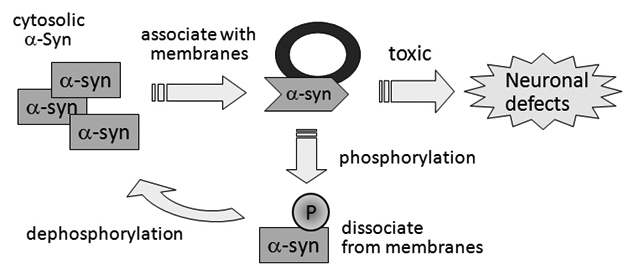
2011年11月2日
新しい論文をBiochemical Journalに発表しました
Genta Ito and Takeshi Iwatsubo
Biochemical Journal 441(3):987-994 (2012)
First Published on November 2, 2011, doi: 10.1042/BJ20111215
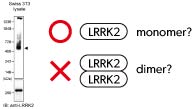
家族性パーキンソン病(PARK8)の病因遺伝子産物leucine-rich repeat kinase 2(LRRK2)は、2量体として機能することが示唆されていました。しかしながら、私たちは、様々な生化学実験の結果をもとに、LRRK2が実際には主に単量体として存在すること、および2量体化はLRRK2の機能に影響を与えないことを明らかにしました。LRRK2の性状に関するこれまでの誤った理解を修正し、さらに詳細な生化学的性状や機能制御メカニズムに迫る足がかりとなる重要な知見です。
2011年10月14日
新しい論文をThe EMBO Journalに発表しました
Phenylpiperidine-type γ-secretase modulators target the transmembrane domain 1 of presenilin 1
Yu Ohki, Takuya Higo, Kengo Uemura, Naoaki Shimada, Satoko Osawa, Oksana Berezovska, Satoshi Yokoshima, Tohru Fukuyama, Taisuke Tomita, Takeshi Iwatsubo
The EMBO Journal 30:4815-4824 (2011)
First Published on October 14, 2011, doi: 10.1038/emboj.2011.372
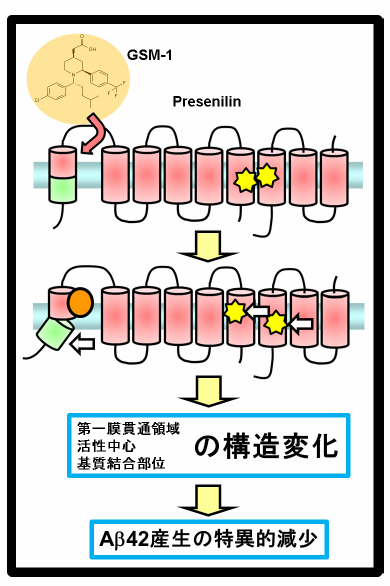
我々は世界で初めてγセクレターゼモジュレーター(GSM)の結合部位の同定に成功しました。毒性分子種であるAβ42産生を特異的に抑制するGSMはアルツハイマー病根本治療薬として期待されています。私たちは、このGSMの分子機構を探るため、ケミカルバイオロジーと生化学的手法を駆使し、GSM-1という化合物がγセクレターゼの活性中心サブユニットであるプレセニリンの第1膜貫通領域に直接結合し、アロステリックな構造変化を引き起こすことでγセクレターゼ活性を制御することを見出しました。この第1膜貫通領域とGSMの結合様式の解明は、GSMのラショナルなドラックデザインにつながるものであり、新たな観点からのアルツハイマー病根本的治療薬の開発に貢献するものと考えられます。本研究は本学天然物合成化学教室横島聡准教授、福山透教授ら、米国マサチューセッツジェネラルホスピタルOksana Berezovska准教授、植村健吾研究員らとの共同研究により進められました。
2011年7月4日
新しい論文をOncogeneに発表しました
Hayashi I, Takatori S, Urano Y, Miyake Y, Takagi J, Sakata-Yanagimoto M, Iwanari H, Osawa S, Morohashi Y, Li T, Wong PC, Chiba S, Kodama T, Hamakubo T, Tomita T, Iwatsubo T
Oncogene 31:787-798 (2011)
First Published on July 4, 2011, doi: 10.1038/onc.2011.265
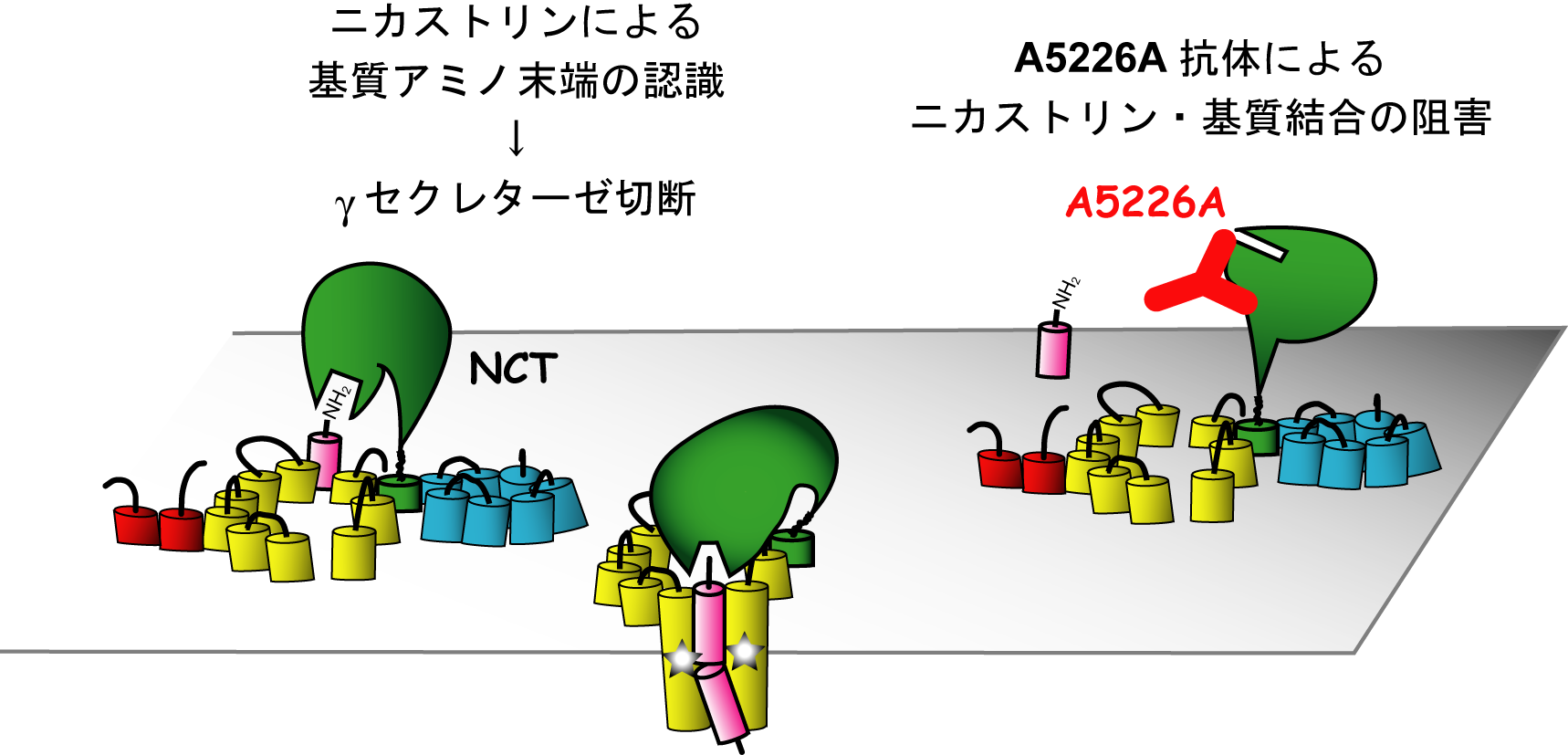
我々は世界で初めてNicastrinを標的としたγセクレターゼ活性中和抗体の樹立に成功しました。これまでに報告されたすべてのγセクレターゼ阻害剤はPSを標的分子とすることが示されています。一方、NCTは構成因子の中で最大の細胞外領域を有し、γセクレターゼが基質を捕捉する際に働く「基質受容体」であることが示唆されています。私たちは、このNCTを標的とした新規γセクレターゼ活性制御法のラショナルデザインを目指し、NCTに対する特異的抗体がγセクレターゼ活性に対する機能阻害抗体として働き、アミロイドβ蛋白の産生を抑制する他、γセクレターゼ活性依存性に増殖を示すがん細胞の腫瘍形成を抑制することを見出しました。A5226Aは、γセクレターゼ阻害剤として初めてPS以外の構成因子を作用点とするものであり、その活性阻害機序の解明を通じてγセクレターゼの基質切断機構に新たな知見をもたらすことが期待されます。本研究は東京大学先端科学技術研究センターの浜窪隆雄・児玉龍彦両教授、筑波大学大学院血液内科の千葉滋教授、大阪大学蛋白質研究所の高木淳一教授らとの共同研究により進められました。
2011年6月2日
新しい論文をThe Journal of Biological Chemistryに発表しました
Three-dimensional Structure of the Signal Peptide Peptidase
Hiroyuki Miyashita, Yuusuke Maruyama, Hayato Isshiki, Satoko Osawa, Toshihiko Ogura, Kazuhiro Mio, Chikara Sato, Taisuke Tomita, Takeshi Iwatsubo
The Journal of Biological Chemistry 286(29):26188-26197 (2011)
First Published on June 2, 2011, doi: 10.1074/jbc.M111.260273
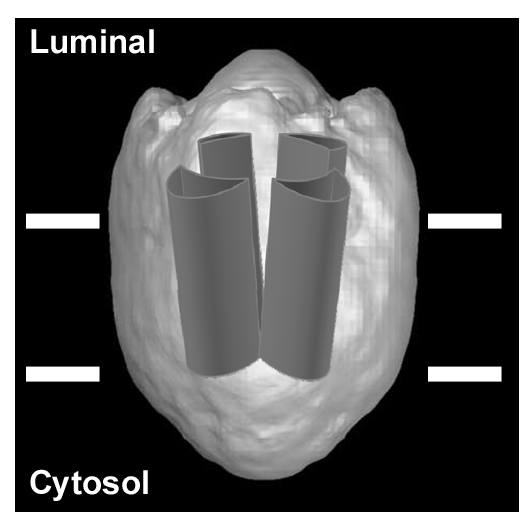
我々は世界で初めてSignal peptide peptidase(SPP)の三次元構造を明らかにしました。SPPはγセクレターゼの活性中心サブユニットPresenilinと同じ膜内配列切断酵素ファミリーに属し、C型肝炎ウイルスやマラリアの増殖などに関わることが知られている、新規創薬標的分子です。我々はSPPの立体構造の理解を目剤し、単粒子解析による構造解析を行いました。その結果、SPPが4量体構造をとって活性を発揮すること、内部に親水性環境をもつ弾丸様構造をとること、またSPPのN末端領域がその4量体構造の形成に必要であることを見出しました。活性型SPP構造の理解はC型肝炎などの画期的創薬に繋がる可能性があります。本研究は産業技術総合研究所・バイオメディカル研究部門・佐藤主税先生のグループとの共同研究により進められました。
2011年5月4日
新しい論文をThe Journal of Neuroscienceに発表しました
BACE1 Activity Is Modulated by Cell-Associated Sphingosine-1-Phosphate
Nobumasa Takasugi, Tomoki Sasaki, Kunimichi Suzuki, Satoko Osawa, Hayato Isshiki, Yukiko Hori, Naoaki Shimada, Takuya Higo, Satoshi Yokoshima, Tohru Fukuyama, Virginia M.-Y. Lee, John Q. Trojanowski, Taisuke Tomita, Takeshi Iwatsubo
The Journal of Neuroscience 31(18):6850-6857 (2011)
First Published on May 4, 2011, doi: 10.1523/JNEUROSCI.6467-10.2011
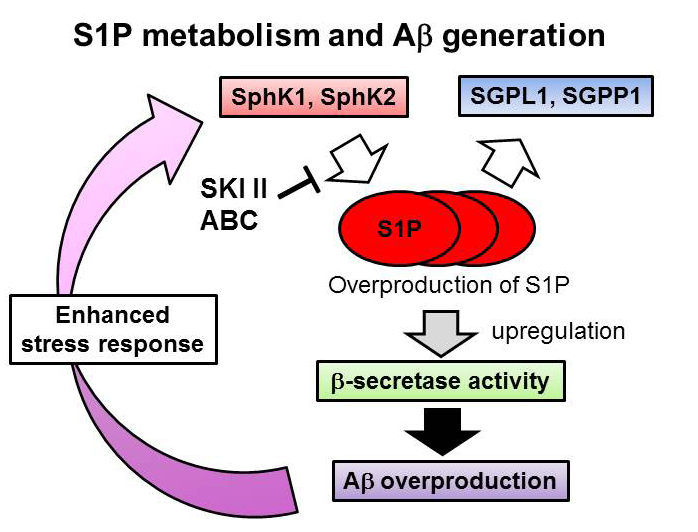
我々は世界で初めてリゾリン脂質の一つであるスフィンゴシン1リン酸(S1P)が神経細胞においてβセクレターゼであるBACE1の活性を制御する因子であることを見出しました。S1Pは様々な生理活性を持つことが知られている脂質で、その産生酵素の一つSphingosine kinase2により合成されるS1PがBACE1活性制御に関与していること、またこのKinase活性がアミロイド線維により亢進することや、アルツハイマー病患者脳において上昇していることを明らかにしました。すなわち、アミロイド毒性がS1P産生を亢進させ、BACE1活性が上昇し、さらなるAβ産生を引き起こす、Vicious cycleが想定されました。すなわち、S1P産生・代謝経路の異常がアルツハイマー病発症過程および増悪化に大きく関与している可能性が考えられ、新たな治療薬標的パスウェイとなることが期待されます。
2010年11月24日
新しい論文をThe Journal of Neuroscienceに発表しました
Shizuka Takagi, Aya Tominaga, Chihiro Sato, Taisuke Tomita, Takeshi Iwatsubo
The Journal of Neuroscience 30(47):15943-15950 (2010)
First Published on November 24, 2010, doi: 10.1523/JNEUROSCI.3318-10.2010
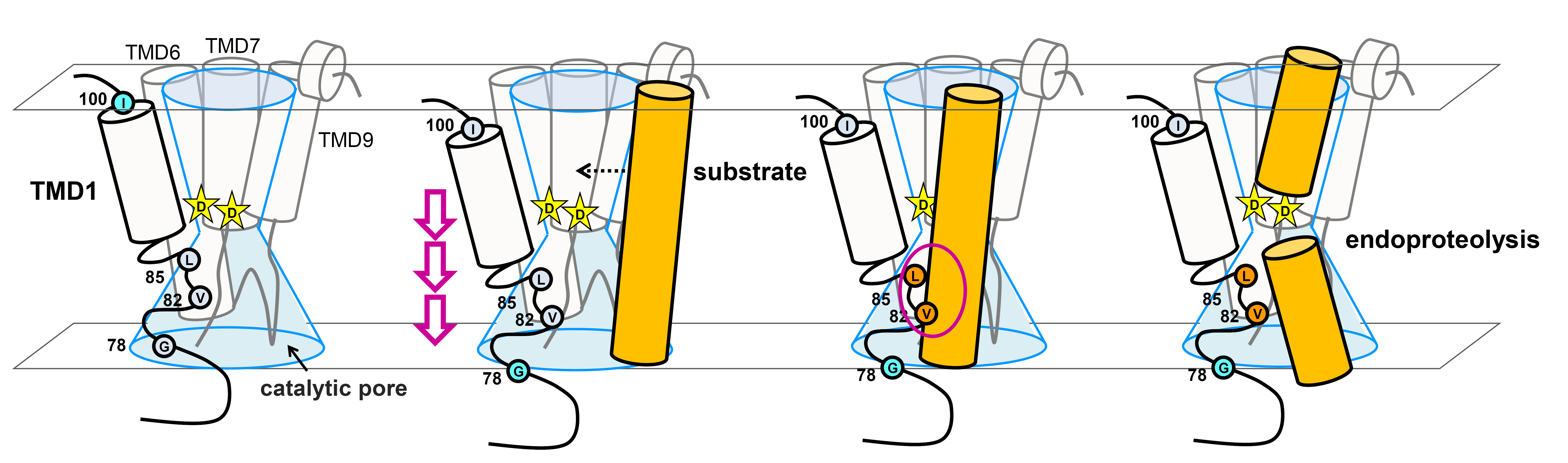
これまで、γセクレターゼの活性中心サブユニットプレセニリンについてはシステインケミストリーを用いた構造解析法SCAMを用いて活性中心ポア構造の存在を示してきました。今回、世界で初めてプレセニリンのアミノ末端側の第一膜貫通領域の構造解析に成功し、活性中心ポア構造に直接面していることを明らかにしました。そして基質の選択性にも関わっていることをあきらかにしました。さらに阻害剤を利用した解析から、この膜貫通領域が切断過程においてピストン様の上下運動をしていることが示唆されました。これは世界で初めてγセクレターゼのダイナミックな構造変化を示唆した研究成果であり、今後の解析から、γセクレターゼによる膜内配列切断機構についてさらに詳細なメカニズムが明らかになることが期待されます。
2010年4月23日
新しい論文をThe Journal of Biological Chemistryに発表しました
Naoto Watanabe, Shizuka Takagi, Aya Tominaga, Taisuke Tomita, Takeshi Iwatsubo
The Journal of Biological Chemistry 285(26):19738-19746 (2010)
First Published on April 23, 2010, doi: 10.1074/jbc.M110.101287
γセクレターゼはプレセニリン、ニカストリン、Aph-1、Pen-2を最小構成因子とする膜蛋白複合体です。活性中心サブユニットであるプレセニリンには活性中心ポア構造の他、基質を脂質二重膜内で側方より捕捉する基質結合部位(Initial substrate-binding site)の存在が示唆されています。本研究においてはシステマチックにプレセニリン1(PS1)の膜貫通領域(TMD)を置換してその変異体の機能解析を行う、以前の研究(Watanabe et al., JBC 2005)をさらに進めました。そして各TMDが活性型γセクレターゼ形成過程において果たす役割について明らかにしました(スキーム)。また化合物を利用したケミカルバイオロジーや、システインを用いたクロスリンク実験などを活用し、TMD2とTMD6がPS1の基質結合部位形成に重要であることを明らかにしました。PSの基質結合部位の詳細を明らかにすることによって、基質特異的なγセクレターゼ活性制御、すなわち、副作用の少ないアルツハイマー病治療薬創成につながる可能性があります。
2009年10月13日
新しい論文をBiochemistryに発表しました
Identification of the Autophosphorylation Sites of LRRK2
Shogo Kamikawaji, Genta Ito, Takeshi Iwatsubo
Biochemistry 48(46):10963-10975 (2009)
First Published on October 13, 2009, doi: 10.1021/bi9011379
家族性パーキンソン病(PARK8)の病因遺伝子産物leucine-rich repeat kinase 2(LRRK2)は、キナーゼ活性依存的に神経毒性を発揮する可能性が提唱されていますが、そのリン酸化基質は明らかになっていません。今回、LRRK2の自己リン酸化部位を同定し、自己リン酸化がLRRK2のキナーゼ活性を抑制する可能性を初めて見出しました。また、自己リン酸化に対するリン酸化特異抗体を作製し、LRRK2のキナーゼ活性をウェスタンブロットで評価できるようになりました。今後の解析から、LRRK2の細胞内活性制御機構や変異型LRRK2の異常機能について、明らかになることが期待されます。
2009年9月9日
新しい論文をThe Journal of Neuroscienceに発表しました
Kaoru Yamada, Chiori Yabuki, Peter Seubert, Dale Schenk, Yukiko Hori, Sumio Ohtsuki, Tetsuya Terasaki, Tadafumi Hashimoto, Takeshi Iwatsubo
The Journal of Neuroscience 29(36):11393-11398 (2009)
First Published on September 9, 2009, doi: 10.1523/JNEUROSCI.2021-09.2009
アルツハイマー病の病因にはAβペプチドからなるβアミロイドの脳内蓄積が重要と考えられています。共同研究者のSchenk博士は、Aβを接種したアミロイド前駆体トランスジェニックマウス脳でβアミロイドの蓄積が顕著に抑制されることから「Aβワクチン療法」を開発しました。この効果は血液中に産生された抗Aβ抗体によることが示され、現在ヒト化抗Aβ抗体を投与する受動免疫療法の臨床治験が開始されています。しかし、脳の外から投与された抗体が、どのようなメカニズムによって脳内のAβ蓄積を抑制するのかは不明でした。特に、現在治験の進められている抗体のいくつかは、血液中で作用し、脳からのAβ排出を促進する(「シンク効果」)と信じられてきましたが、それを実証する知見はありませんでした。今回私たちは、シンク効果を生じると考えられてきた代表的なモノクローナル抗体266が、脳からAβを引き抜くのとは逆に、脳内に進入して治療効果を生じていることを示しました。アルツハイマー病の脳では、単量体型で産生されたAβが、障害性の高いオリゴマーを経て、アミロイドとして蓄積するものと考えられています。今回の結果は、抗Aβ抗体が脳内に進入して可溶・単量体型のAβに結合、これをオリゴマーやアミロイド等の多量体の形成過程から隔離し、阻害するという新規の作用メカニズムを提起するものです。
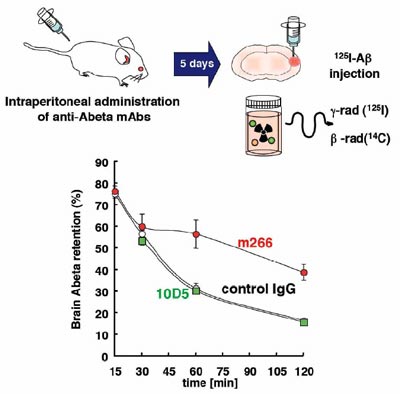
2009年8月14日
新しい論文をThe Journal of Biological Chemistryに発表しました
Single Chain Variable Fragment against Nicastrin Inhibits the γ-Secretase Activity
Ikuo Hayashi, Sho Takatori, Yasuomi Urano, Hiroko Iwanari, Noriko Isoo, Satoko Osawa, Maiko A. Fukuda, Tatsuhiko Kodama, Takao Hamakubo, Tong Li, Philip C. Wong, Taisuke Tomita, Takeshi Iwatsubo
The Journal of Biological Chemistry 284(41):27838-27847 (2009)
First Published on August 14, 2009, doi: 10.1074/jbc.M109.055061
今回、私たちは世界で初めてモノクローナル抗体誘導体を用いたγセクレターゼ活性制御法の開発に成功しました。γセクレターゼはアルツハイマー病脳に蓄積するAβペプチドの産生を行う膜結合型複合体を本態とする酵素です。その構成因子の一つであるニカストリン(Nicastrin)は大きな細胞外領域を持ちます。今回ニカストリンの細胞外領域に対する新規モノクローナル抗体の樹立に成功し、この抗体を基に単鎖抗体を作出しました。この単鎖抗体を培養細胞に発現させたところ、ニカストリン細胞外領域の糖鎖修飾および構造異常を惹起することでγセクレターゼの不安定化を引き起こし、Aβペプチド産生が抑制されることを見出しました。この結果は、ニカストリンの細胞外領域がγセクレターゼの安定性及び活性に重要な役割を果たしていることを示します。またニカストリンがγセクレターゼ活性を制御する創薬標的となりうることを世界で初めて示しました。将来的には、生物製剤の一つとして着目されている「抗体医薬」によるγセクレターゼ活性の制御法開発へつながることが期待されます。本研究は本学先端研 児玉龍彦教授、浜窪隆雄教授との共同研究成果です。
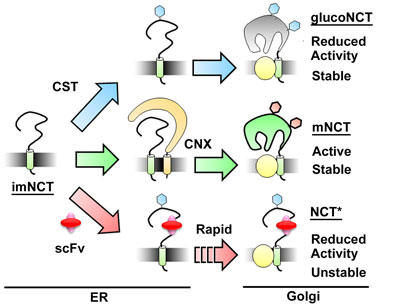
2008年10月21日
新しい論文をThe Journal of Biological Chemistryに発表しました
Kaoru Yamada, Tadafumi Hashimoto, Chiori Yabuki, Yusuke Nagae, Masanori Tachikawa, Dudley K. Strickland, Qiang Liu, Guojun Bu, Jacob M. Basak, David M. Holtzman, Sumio Ohtsuki, Tetsuya Terasaki, Takeshi Iwatsubo
The Journal of Biological Chemistry 283(50):34554-34562 (2008)
First Published on October 21, 2008, doi: 10.1074/jbc.M801487200
2008年7月9日
新しい論文をHuman Molecular Geneticsに発表しました
Tomoki Kuwahara, Akihiko Koyama, Shingo Koyama, Sawako Yoshina, Chang-Hong Ren, Takeo Kato, Shohei Mitani, Takeshi Iwatsubo
Human Molecular Genetics 17(19):2997-3009 (2008)
First Published on July 9, 2008, doi: 10.1093/hmg/ddn198
パーキンソン病やレビー小体型認知症では脳内にα-シヌクレインが蓄積し、またα-シヌクレイン遺伝子の変異はこれらの疾患を引き起こすことが知られています。今回、ヒトα-シヌクレインを神経系に過剰発現する線虫(C. elegans)を作出し、さらにα-シヌクレイン発現依存的に神経障害性を引き起こす遺伝子を網羅的RNAiスクリーニングにより探索しました。その結果、アダプタータンパク質AP-2のサブユニットをはじめとするエンドサイトーシス関連遺伝子の抑制により、α-シヌクレインによる神経障害性が増強されることが分かりました。本研究で作出した線虫はヒト疾患の病態を再現するモデルとして今後薬物スクリーニングなど創薬への応用が期待されます。
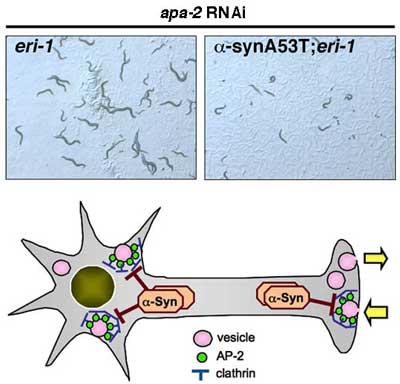
2008年6月11日
新しい論文をThe Journal of Neuroscienceに発表しました
Chihiro Sato, Shizuka Takagi, Taisuke Tomita, Takeshi Iwatsubo
The Journal of Neuroscience 28(24):6264-6271 (2008)
First Published on June 11, 2008, doi: 10.1523/JNEUROSCI.1163-08.2008
2008年3月Keystone meetingにおいて発表した、γ-secretaseに関する構造活性相関解析に関する最新の知見について、Alzforumの"Keystone Basic Science News"のトップ記事としてfeatureされました("γ Slowly Relinquishes Its Secrets" http://www.alzforum.org/new/detail.asp?id=1812)。γ-secretaseによる膜内配列切断機構において、どのようにして基質が活性中心ポアに移動してくるのかについて、システインケミストリーを利用したSCAMにより解明した成果です。

2007年11月26日
新しい論文をNeuroscience Lettersに発表しました
Cytoplasmic localization and proteasomal degradation of N-terminally cleaved form of PINK1.
Sho Takatori, Genta Ito, Takeshi Iwatsubo
Neuroscience Letters 430(1):13-17 (2008)
First Published on November 26, 2008, doi: 10.1016/j.neulet.2007.10.019
PINK1は劣性遺伝性のパーキンソニズムの病因遺伝子として同定されましたが、その代謝過程には不明の点が残されていました。今回PINK1はアミノ末端側のシグナル配列によりミトコンドリアにターゲットされること、N末端を欠いた断片型PINK1タンパク質がプロテアソームによる分解を受けることを明らかにしました。
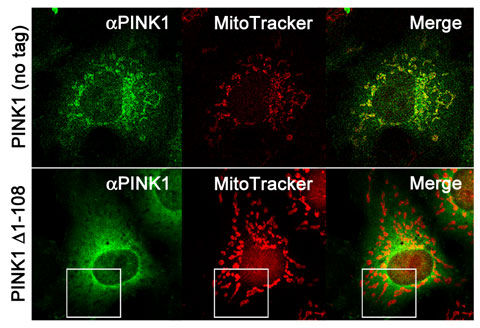
2007年2月28日
新しい論文をThe Journal of Biological Chemistryに発表しました
Noriko Isoo, Chihiro Sato, Hiroyuki Miyashita, Mitsuru Shinohara, Nobumasa Takasugi, Yuichi Morohashi, Shoji Tsuji, Taisuke Tomita, Takeshi Iwatsubo
The Journal of Biological Chemistry 282(17):12388-12396 (2007)
First Published on February 28, 2007, doi: 10.1074/jbc.M611549200
老人斑としてアルツハイマー病脳に蓄積するAβペプチドのうち、特にAβ42は凝集性が高く、病初期から蓄積が見られること、また家族性アルツハイマー病を起こす遺伝子変異によりその産生が特異的に上昇することなどから、その発症機序に重要な役割を果たすことが指摘されています。今回γセクレターゼ構成因子Pen-2のN末タグによる変化をきっかけとして、Aβ42産生活性上昇に伴いγセクレターゼの活性中心ポアが構造変化していることを見出しました。この結果は、副作用の少ないアルツハイマー病治療薬への応用が期待されているγセクレターゼモジュレーターの作動機序を説明する可能性があります。引き続き活性中心ポアを含めたγセクレターゼの構造と活性の相関を検討していくことで、将来的に創薬につながることが期待されます。
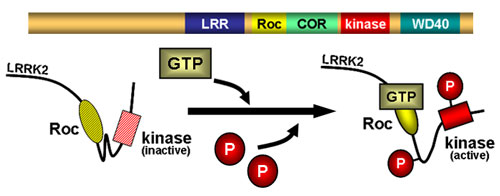
2007年1月13日
新しい論文をBiochemistryに発表しました
Genta Ito, Takuro Okai, Go Fujino, Kohsuke Takeda, Hidenori Ichijo, Toshiaki Katada, Takeshi Iwatsubo
Biochemistry 46(5):1380-1388 (2007)
First Published on January 13, 2007, doi: 10.1021/bi061960m
家族性パーキンソン病(PARK8)の病因遺伝子LRRK2は、家族性のみならず孤発性のパーキンソン病においてもアミノ酸変異が見られることから、パーキンソン病の病因への関与が注目されています。LRRK2蛋白質は、同一分子内に低分子量GTP結合蛋白質様のROCドメインと、キナーゼドメインを併せ持つユニークな構造が特徴的ですが、両者の機能的関連は不明でした。今回LRRK2が細胞内でGTP結合型として存在すること、GTP結合能を失った変異型LRRK2を用いて、ROCドメインへのGTP結合がLRRK2のキナーゼ活性にとって必須であることを明らかにしました。今後LRRK2の機能とその変異による異常を明らかにし、パーキンソン病の分子病態に迫る第一歩となる重要な基礎的知見です。
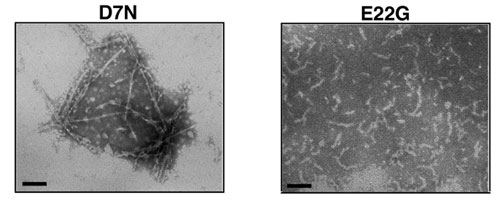
2006年12月14日
新しい論文をThe Journal of Biological Chemistryに発表しました
Yukiko Hori, Tadafumi Hashimoto, Yosuke Wakutani, Katsuya Urakami, Kenji Nakashima, Margaret M. Condron, Satoshi Tsubuki, Takaomi C. Saido, David B. Teplow, Takeshi Iwatsubo
The Journal of Biological Chemistry 282(7):4916-4923 (2007)
First Published on December 14, 2006, doi: 10.1074/jbc.M608220200
脳内に分泌されたAβが凝集する過程で神経細胞死を引き起こすことは、アルツハイマー病発症に重要なステップであると考えられている。そして近年、神経細胞死を起こすAβの分子種としてprotofibrilと呼ばれる可溶な凝集中間体が注目されている。今回堀らはAβ内部に位置し、家族性アルツハイマー病を引き起こす鳥取型(D7N)、英国型(H6R)の二つの点突然変異に注目し、これらの変異が構造変化の核形成には影響を与えないものの、その後の線維伸長を促進することを明らかにした。さらに線維伸長過程を詳細に検討したところ、二つの変異はArctic型変異(E22G)で見られるようなprotofibril形成の促進(図右)とは異なり、アミロイド線維自身の形成を促進している(図左)ことを見いだした。この結果は、protofibrilだけでなくアミロイド線維形成の促進もアルツハイマー病発症を引き起こすことを意味し、今後Aβ凝集メカニズム解明、そして凝集抑制を指標とするアルツハイマー病根本治療薬の開発に重要な知見を与えるものである。
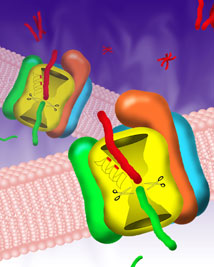
2006年11月15日
新しい論文をThe Journal of Neuroscienceに発表しました
Structure of the Catalytic Pore of γ-Secretase Probed by the Accessibility of Substituted Cysteines
Chihiro Sato, Yuichi Morohashi, Taisuke Tomita, Takeshi Iwatsubo
The Journal of Neuroscience 26(46):12081-12088 (2006)
First Published on November 15, 2006, doi: 10.1523/JNEUROSCI.3614-06.2006
疎水性である脂質二重膜内に存在する膜貫通配列に対して、どのようにしてγセクレターゼがイオン化された水を必要とする加水分解反応を行っているのかについて、その分子機構はまったく不明でした。今回システインに対して親水性環境下でのみ反応するMTS試薬を用い、活性中心となるアスパラギン酸を含む膜貫通領域内の各アミノ酸について、どのような環境にあるかを検討しました。その結果、γセクレターゼの活性中心は脂質二重膜内に存在する親水性の孔(ポア)に面していることが明らかになりました。また各種阻害剤を用い、切断反応に直接関与しているアミノ酸残基を複数同定しました。今後このような構造情報を元に、γセクレターゼの構造活性相関・化合物による阻害機構の解明が可能になると期待されます。本研究は、The Journal of NeuroscienceのThis Week in The Journal(TWIJ Article)に選ばれました。
2006年5月8日
新しい論文をBioorganic and Medicinal Chemistry Lettersに発表しました
Yasuko Takahashi, Haruhiko Fuwa, Akane Kaneko, Makoto Sasaki, Satoshi Yokoshima, Hifumi Koizumi, Tohru Takebe, Toshiyuki Kan, Takeshi Iwatsubo, Taisuke Tomita, Hideaki Natsugari, Tohru Fukuyama
Bioorganic and Medicinal Chemistry Letters 16(14):3813-3816 (2006)
First Published on May 8, 2006, doi: 10.1016/j.bmcl.2006.04.025
新規骨格を持つγセクレターゼ阻害剤の同定は、副作用の少ないアルツハイマー病治療薬開発の上で、必須であると考えられます。今回、本学天然物合成化学教室・創薬理論科学教室との共同研究により、天然物合成中間体を主とする新規in house化合物ライブラリーを作製し、本研究室にて開発されたin vitro γセクレターゼアッセイを用いてスクリーニングしたところ、二つの新規骨格を持つ化合物がγセクレターゼ活性を阻害することを見出し、その構造展開により構造活性相関を試みました。今後この化合物をシードとし、新たな阻害剤探索を試みると同時に、光親和性標識などの分子プローブ化技術を応用することにより、その阻害機構を分子レベルで明らかにすることが可能になると期待されます。本研究は、本学COE「戦略的基礎創薬科学」のプロジェクトとして行われた共同研究成果です。
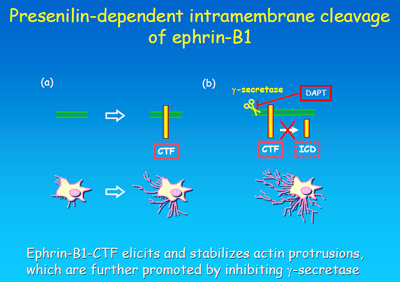
2006年6月12日
新しい論文をMolecular Neurodegenerationに発表しました
Presenilin-dependent intramembrane cleavage of ephrin-B1
Taisuke Tomita, Sayaka Tanaka, Yuichi Morohashi, Takeshi Iwatsubo
Molecular Neurodegeneration 1:2 (2006)
First Published on June 12, 2006, doi: 10.1186/1750-1326-1-2
どのような蛋白がγセクレターゼによる膜内配列切断の基質となっているかということは、γセクレターゼ阻害剤によるアルツハイマー病治療における副作用を考える上でも重要です。今回ephrin-B1がγセクレターゼの基質であること、その切断によってアクチン性突起の伸長に影響を及ぼすことを見出しました。ephrin-BはEphレセプターとの相互作用を介して異種細胞間情報伝達に寄与しており、神経細胞のシナプス可塑性への関与も報告されています。今後γセクレターゼ阻害剤によるephrin-Bの切断抑制が、脳内でどのような効果を引き起こすかを明らかにすることが重要であると考えられます。
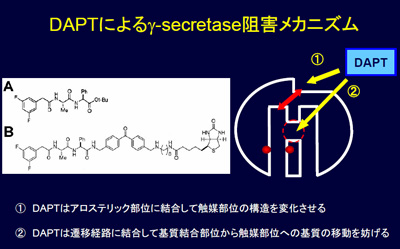
2006年3月28日
新しい論文をThe Journal of Biological Chemistryに発表しました
Yuichi Morohashi, Toshiyuki Kan, Yusuke Tominari, Haruhiko Fuwa, Yumiko Okamura, Naoto Watanabe, Chihiro Sato, Hideaki Natsugari, Tohru Fukuyama, Takeshi Iwatsubo, Taisuke Tomita
The Journal of Biological Chemistry 281(21):14670-14676 (2006)
First Published on March 28, 2006, doi: 10.1074/jbc.M513012200
γセクレターゼ阻害剤がどのような分子メカニズムによって酵素活性を阻害するかということは、新規阻害剤の探索のみならず、その切断機構の理解の上で重要です。今回γ-secretase特異的阻害剤であるDAPT(A)に、光親和性標識基・ビオチン基を導入したDAP-BpB(B)の合成に成功しました。そしてこの化合物を分子プローブとして用い、DAPTの標的分子がプレセニリンC末端断片であり、基質が活性中心に移行する過程を阻害している可能性を見出しました。本研究はこれまで作用点が明らかでなかったDAPTの作用機序を世界で初めて明らかにしたと同時に、ケミカルバイオロジー的アプローチによってγ-secretaseの切断機構の一端を明らかにしたという意味で、有意義な研究成果です。今後同様の手法により、様々な化合物の作用機序を明らかにすることができるものと期待されます。本研究は、本学COEプロジェクトの一つとして行われた、天然物合成化学教室・創薬理論科学教室との共同研究成果です。
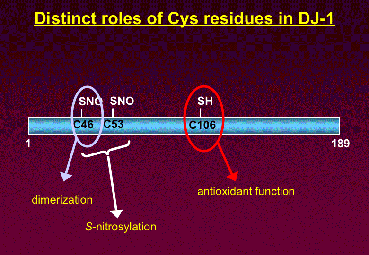
2005年11月18日
新しい論文をBiochemical and Biophysical Research Communicationsに発表しました
Roles of distinct cysteine residues in S-nitrosylation and dimerization of DJ-1
Genta Ito, Hiroyoshi Ariga, Yasuhito Nakagawa, Takeshi Iwatsubo
Biochemical and Biophysical Research Communications 339(2):667-672 (2006)
First Published on November 18, 2005, doi: 10.1016/j.bbrc.2005.11.058
家族性パーキンソニズム(park7)の病因遺伝子産物DJ-1蛋白質は、3つのシステイン残基を持ち、そのうちCys106が酸化ストレス耐性に重要であることが示されていましたが、他のシステイン残基の役割は不明でした。今回DJ-1がCys46, Cys53でS-ニトロシル化を受けること、Cys46は二量体化にも重要な役割を果たすことを培養細胞を用いたラベリング実験から明らかにしました。パーキンソニズムと酸化ストレスの関係を追求する上で興味深い結果と考えられます。
2005年10月31日
新しい論文をThe Journal of Biological Chemistryに発表しました
Tomoki Kuwahara, Akihiko Koyama, Keiko Gengyo-Ando, Mayumi Masuda, Hisatomo Kowa, Makoto Tsunoda, Shohei Mitani, Takeshi Iwatsubo
The Journal of Biological Chemistry 281(1):334-340 (2006)
First Published on October 31, 2005, doi: 10.1074/jbc.M504860200
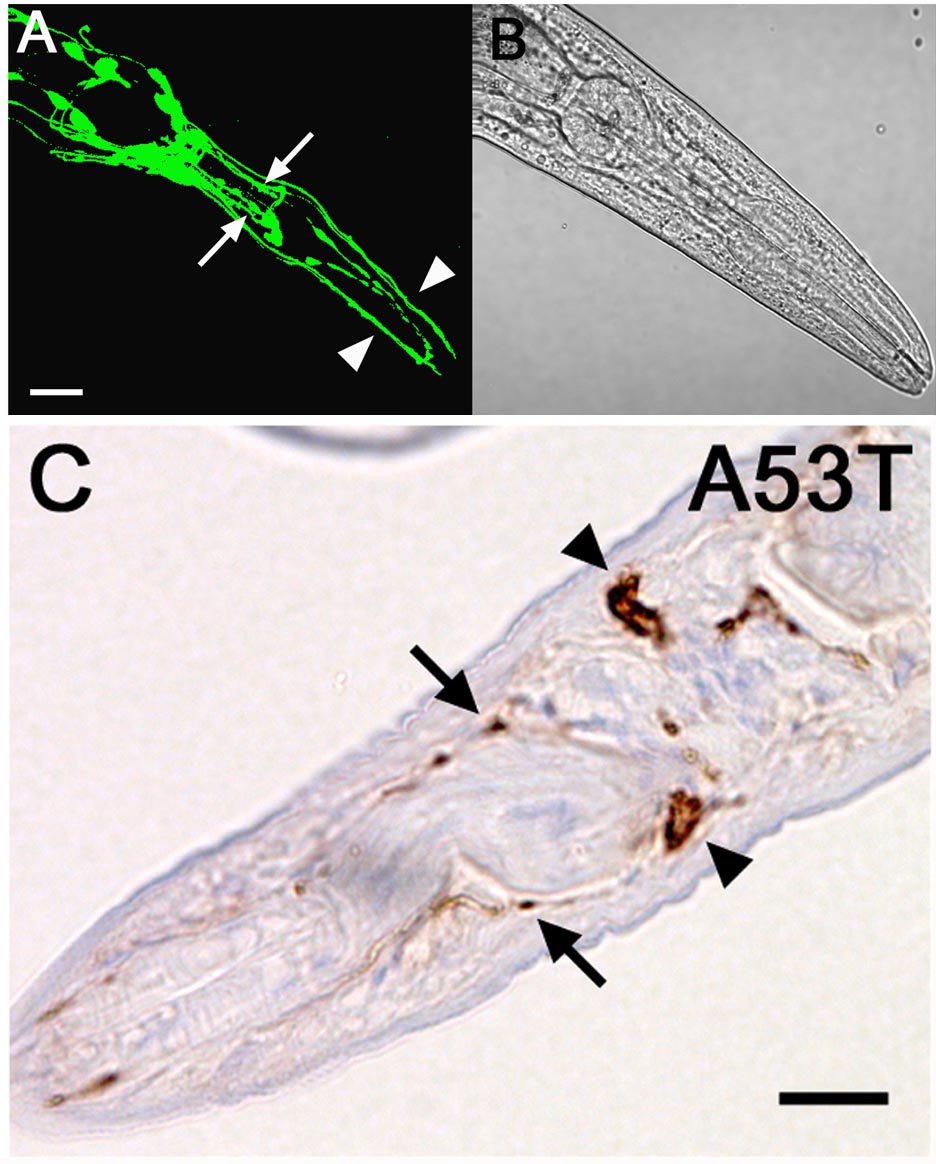
α-シヌクレインはパーキンソン病の変性ニューロンにレビー小体として蓄積し、家族性パーキンソン病の病因遺伝子でもあることから原因との関連が注目されています。今回東京女子医大・三谷昌平博士の協力により、ドパミン性神経細胞に家族性パーキンソン型変異α-シヌクレインを発現するトランスジェニック線虫(C. elegans)を作出し、ドパミン神経細胞の異常を再現することに成功しました。今後関連遺伝子の解析や創薬に有力なモデルとなることが期待されます。 (Aは線虫のモノアミン性神経細胞の蛍光像、Bはノマルスキ顕微鏡像、CはA53T変異α-シヌクレイン発現TG線虫ドパミン神経の免疫染色像)
2005年10月18日
新しい論文をThe Journal of Biological Chemistryに発表しました
Naoto Watanabe, Taisuke Tomita, Chihiro Sato, Toshio Kitamura, Yuichi Morohashi, Takeshi Iwatsubo
The Journal of Biological Chemistry 280(51):41967-41975 (2005)
First Published on October 18, 2005, doi: 10.1074/jbc.M509066200
PS、Nct、Aph-1、Pen-2の四つの膜蛋白からなる複合体γセクレターゼの構造学的解析は非常に困難です。しかしその構造活性相 関情報は、創薬の上でも重要です。今回渡邊らは、PSの各膜貫通領域を異なる蛋白にスワップした変異体を用いて検討しました。その結果、Pen-2が PS1のTMD4に直接結合することがあきらかとなりました。 Pen-2の結合はγセクレターゼ活性化の最終段階と考えられており、今後Pen-2の結合が分子レベルでどういった変化を起こしているかを明らかにすることにより、γセクレターゼの構造活性相関の理解に近づくものと期待されます。
2005年1月11日
新しい論文をThe Journal of Biological Chemistryに発表しました
Manabu Niimura, Noriko Isoo, Nobumasa Takasugi, Makiko Tsuruoka, Kumiko Ui-Tei, Kaoru Saigo, Yuichi Morohashi, Taisuke Tomita, Takeshi Iwatsubo
The Journal of Biological Chemistry 280(13):12967-12975 (2005)
First Published on January 11, 2005, doi: 10.1074/jbc.M409829200
2004年12月21日
新しい論文をThe Journal of Biological Chemistryに発表しました
Yoshihide Osada, Tadafumi Hashimoto, Akiko Nishimura, Yuko Matsuo, Tomoko Wakabayashi, Takeshi Iwatsubo
The Journal of Biological Chemistry 280(9):8596-8605 (2005)
First Published on December 21, 2004, doi: 10.1074/jbc.M413340200
2004年6月23日
新しい論文をThe Journal of Biological Chemistryに発表しました
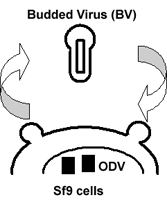
Ikuo Hayashi, Yasuomi Urano, Rie Fukuda, Noriko Isoo, Tatsuhiko Kodama, Takao Hamakubo, Taisuke Tomita, Takeshi Iwatsubo
The Journal of Biological Chemistry 279(36):38040-38046 (2004)
First Published on June 23, 2004, doi: 10.1074/jbc.M405597200
アルツハイマー病の脳アミロイドの主成分であるAβペプチドを膜内で切り出すγセクレターゼは、プレセニリンをはじめとする4種類の膜蛋白の複合体から成ることから、in vitroで、高いプロテアーゼ活性を保った状態で再構成することは困難でした。今回林らは、東大先端研の浜窪・児玉教授のグループとの共同研究により、バキュロウィルスの発芽小胞上に、ヒト型γセクレターゼを高い効率で再構成することに成功しました。今回確立された方法を用いることにより、γセクレターゼの構造活性相関の解明や、効率的な阻害剤のスクリーニングが飛躍的に進むものと期待されます。図はバキュロウイルスから発芽する発芽小胞上にγ-secretase複合体を発現させる模式図
2004年3月30日
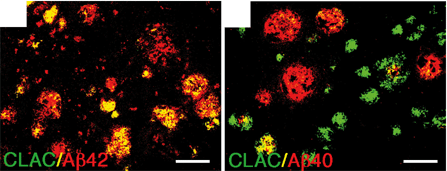
新しい論文をThe American Journal of Pathologyに発表しました
Hisatomo Kowa, Tomoko Sakakura, Yusuke Matsuura, Tomoko Wakabayashi, David M.A. Mann, Karen Duff, Shoji Tsuji, Tadafumi Hashimoto, Takeshi Iwatsubo
The American Journal of Pathology 165(1):273-281 (2004)
First Published on March 30, 2004, doi: 10.1016/S0002-9440(10)63295-6
アルツハイマー病の脳に蓄積する老人斑のアミロイドには、Aβペプチド以外にも様々な蛋白質性成分が含まれることが知られています。我々の研究室では、神経細胞特異的に発現する膜結合型コラーゲンCLAC-Pの細胞外部分がCLAC蛋白として老人斑に蓄積することを見出しました(HashimotoT. et al. EMBO J, 2002)。今回古和らは、アルツハイマー脳に多発するCLAC陽性老人斑は、thioflavinSやAβ40陽性を示す典型的なアミロイド斑とオーバーラップしない、特異なサブポピュレーションを形成することを病理学的に示しました。この結果は、CLACがアミロイド蓄積に果たす役割を考える上で、重要な手掛かりを与えるものです。図はアルツハイマー病患者脳老人斑においてCLACとAbの共焦点顕微鏡による観察像。CLACはAb42(左)と共存するが、Ab40(右)とは相反する染色像を示す。
2003年3月16日
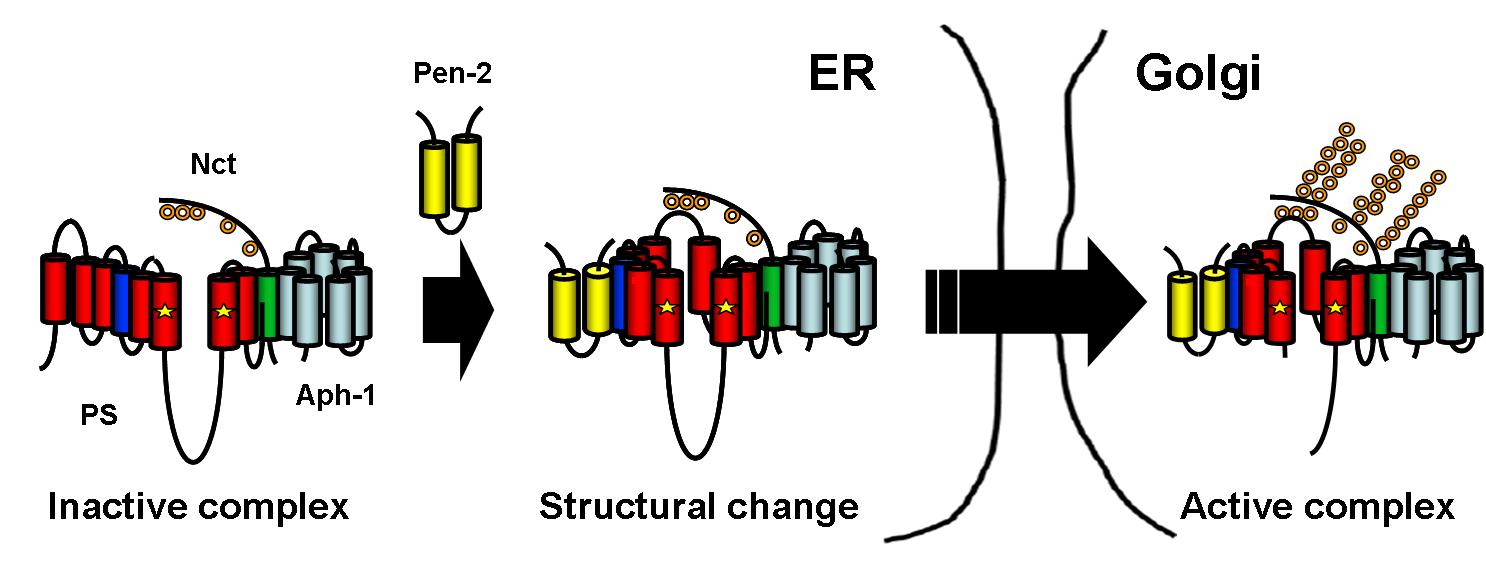
新しい論文をNatureに発表しました
The role of presenilin cofactors in the γ-secretase complex
Nobumasa Takasugi, Taisuke Tomita, Ikuo Hayashi, Makiko Tsuruoka, Manabu Niimura, Yasuko Takahashi, Gopal Thinakaran, Takeshi Iwatsubo
Nature 422:438-441 (2003)
First Published on March 16, 2003, doi: 10.1038/nature01506
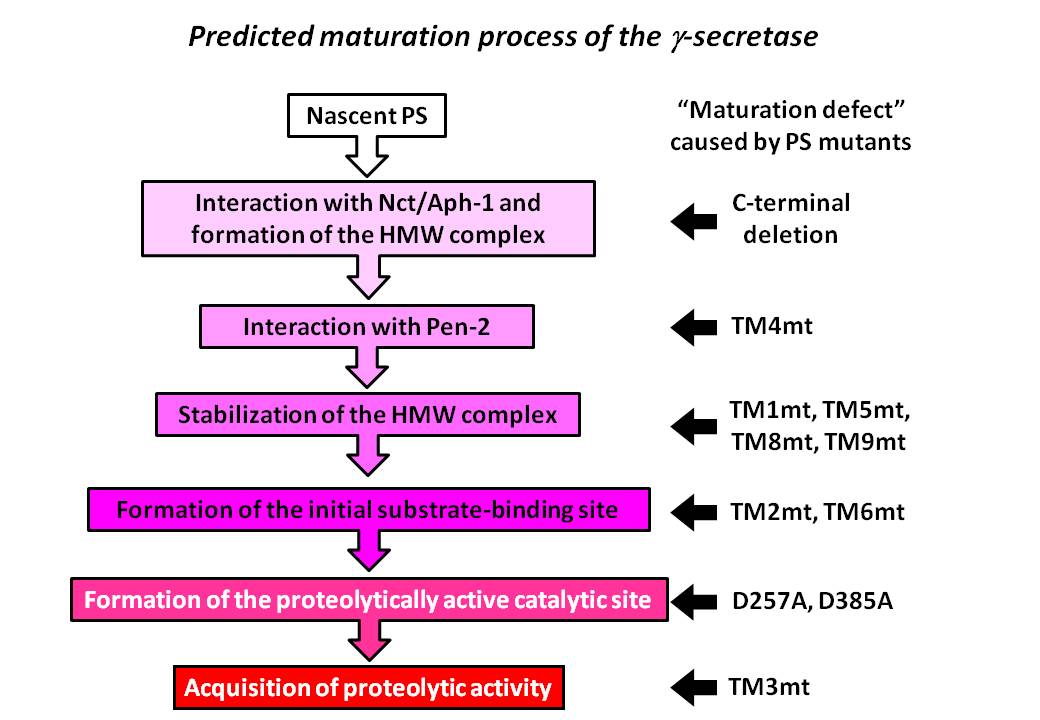
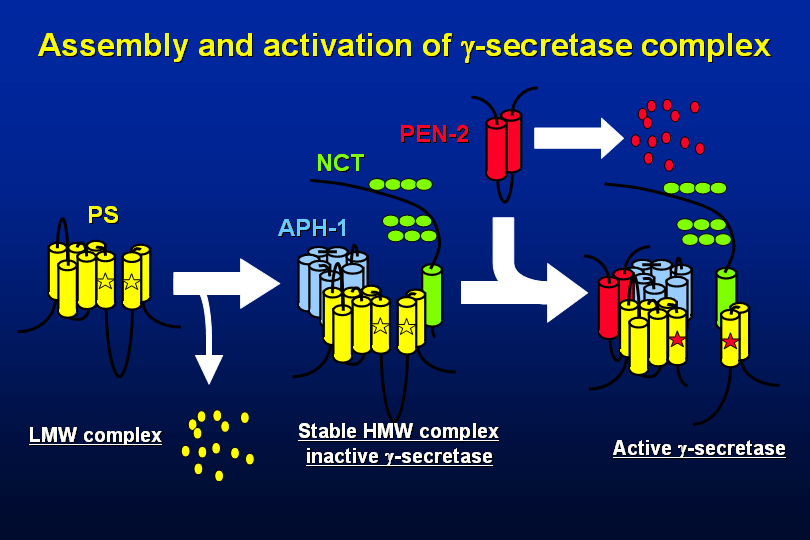
γ-secretase複合体に含まれる構成因子として、活性中心を担っていると考えられているプレセニリン(PS)のほかに、ニカストリン(NCT)、APH-1、PEN-2が同定されています。これらの因子はいずれもγ-secretase活性に必須であることが知られていますが、それぞれの役割については不明でした。そこで私たちはショウジョウバエにおいてもγ-secretaseによる切断機構が保存されていることに着目し、RNAi(二本鎖RNAによるRNA干渉法、遺伝子発現を低下させることができる)及び過剰発現系を用いてこれらの因子がγ-secretase活性に及ぼす影響について検討し ました。その結果まずPSにNCT、APH-1が結合し安定化され、その後PEN-2によって活性型γ-secretaseになることがわかりました(図)。今後それぞれの因子の機能を更に詳細に検討することにより、γ-secretaseによる切断機構を明らかにすることが可能になるものと考えられます。またこれらの因子に対する低分子化合物が新しいγ-secretase阻害剤となることが期待され、これまでにない新しいタイプのアルツハイマー病治療薬に結びつく可能性があります。以上の研究結果は日本経済新聞、共同通信、朝日新聞で配信されました。
2003年3月10日
新しい論文をThe Journal of Biological Chemistryに発表しました
Yasuko Takahashi, Ikuo Hayashi, Yusuke Tominari, Kentaro Rikimaru, Yuichi Morohashi, Toshiyuki Kan, Hideaki Natsugari, Tohru Fukuyama, Taisuke Tomita, Takeshi Iwatsubo
The Journal of Biological Chemistry 278(20):18664-18670 (2003)
First Published on March 10, 2003, doi: 10.1074/jbc.M301619200
γ-secretaseはAPPのみならず他の基質も切断することから、γ-secretase阻害によるアルツハイマー病治療・予防については、重篤な副作用が懸念されています。疫学的調査より、非ステロイド性抗炎症薬の服用がアルツハイマー病の発症リスクを低下させることが報告されています。そのメカニズムについては不明ですが、主に脳内での抗炎症作用によるものであると考えられてきました。しかし2001年、一部の非ステロイド性抗炎症薬がγ-secretase活性に影響を与え、Aβ42産生を特異的に阻害すること、また Notch切断は阻害しないことが報告されました。そこで私たちは非ステロイド性抗炎症役が直接γ-secretaseに対して阻害作用を持つかどうかを検討するため、in vitro γ-secretaseアッセイ系を構築し検討しました。その結果Sulindac sulfideはAβ42産生を有意に阻害すること、また高濃度ではAβ40産生、Notch切断も阻害するγ-secretase阻害剤であることを証明しました。今後Sulindac sulfideをリード化合物とした創薬を行うことで、Aβ42産生のみを抑制し、副作用の少ないアルツハイマー病予防・治療薬の開発につながるものと期待されます。
2003年1月23日
新しい論文をNeuroscience Lettersに発表しました
Makio Takahashi, Hirotaka Kanuka, Hideo Fujiwara, Akihiko Koyama, Masato Hasegawa, Masayuki Miura, Takeshi Iwatsubo
Neuroscience Letters 336(3):155-158 (2003)
doi: 10.1016/S0304-3940(02)01258-2
2002年10月17日
新しい論文をThe Journal of Biological Chemistryに発表しました
Nobumasa Takasugi, Yasuko Takahashi, Yuichi Morohashi, Taisuke Tomita, Takeshi Iwatsubo
The Journal of Biological Chemistry 277(51):50198-50205 (2002)
First Published on October 17, 2002, doi: 10.1074/jbc.M2053522002
プレセニリンを含んだ高分子量複合体は、γ-secretaseそのものである可能性が示唆されています。プレセニリンはさまざまな動物種のみならず、植物にまで広く存在することから、γ-secretaseによる切断機構がさまざまな生物において重要である可能性が高いと考えられています。実際に、マウスやショウジョウバエにおいては、γ-secretaseによるNotchレセプターの切断が、初期発生に重要であることが示されています。しかしショウジョウバエプレセニリン蛋白そのものについての解析は、ほとんど行われてきていませんでした。今回私たちはこのショウジョウバエプレセニリンについて生化学的検討を行い、ヒトプレセニリンと同様の分子機構を用いて高分子量複合体を形成し、γ-secretase活性を発揮することを示しました。また最近、二本鎖 RNA を用いて遺伝子発現を低下させる、RNAi(dsRNA mediated interference)という手法が、ショウジョウバエ個体や、培養細胞系で有効であることがわかってきました。私たちはショウジョウバエS2細胞にヒトと同様のγ-secretase活性が存在し、RNAiを用いてプレセニリンをノックダウンし、実際にγ-secretase 活性が低下することを確認しました。今後ショウジョウバエのゲノム情報を元に、S2細胞を用いて過剰発現系及びRNAiを活用していくことで、γ-secretaseに関わる分子機構を明らかにしていくことができるものと考えています。
2002年10月10日
新しい論文をThe Journal of Biological Chemistryに発表しました
Phosphorylated α-Synuclein Is Ubiquitinated in α-Synucleinopathy Lesions
Masato Hasegawa, Hideo Fujiwara, Takashi Nonaka, Koichi Wakabayashi, Hitoshi Takahashi, Virginia M.-Y. Lee, John Q. Trojanowski, David Mann, Takeshi Iwatsubo
The Journal of Biological Chemistry 277(50):49071-49076 (2002)
First Published on October 10, 2002, doi: 10.1074/jbc.M208046200
2002年2月14日
新しい論文をThe Journal of Biological Chemistryに発表しました
Yuichi Morohashi, Noriyuki Hatano, Susumu Ohya, Rie Takikawa, Tomonari Watabiki, Nobumasa Takasugi, Yuji Imaizumi, Taisuke Tomita, Takeshi Iwatsubo
The Journal of Biological Chemistry 277(17):14965-14975 (2002)
First Published on February 14, 2002, doi: 10.1074/jbc.M200897200
家族性アルツハイマー病の原因遺伝子プレセニリンは、脳アミロイドの主要構成成分であるβアミロイドの産生にかかわる酵素である、γ-secretaseに必須な分子であることが知られてます。その役割は明確ではありませんが、プレセニリンやさまざまな蛋白を含んだ高分子量複合体がγ-secretaseそのものである可能性が示唆されています。今回我々はPS2のC末端部分を釣り針(bait)とした2-hybrid法によるスクリーニングによって新たな結合蛋白CALPを同定しました。培養細胞を用いた解析から、CALPは細胞内でPS2と相互作用している一方、γ-secretaseとしての機能には大きな影響を与えないことを見出しました。またCALPがすでに報告されていた電位依存性カリウムチャンネルの機能修飾因子であるKChIPファミリーと相同性が高かったことから、CALPがカリウム電流に対する影響を検討したところ、CALPはKv4.2チャンネルに結合してA型カリウム電流を調節し、KChIPとしての機能を持っていることを見出しました。
2002年2月8日
新しい論文をThe EMBO Journalに発表しました
Tadafumi Hashimoto, Tomoko Wakabayashi, Atsushi Watanabe, Hisatomo Kowa, Ritsuko Hosoda, Atsushi Nakamura, Ichiro Kanazawa, Takao Arai, Koji Takio, David M.A. Mann, Takeshi Iwatsubo
The EMBO Journal 21(7):1524-1534 (2002)
doi: 10.1093/emboj/21.7.1524
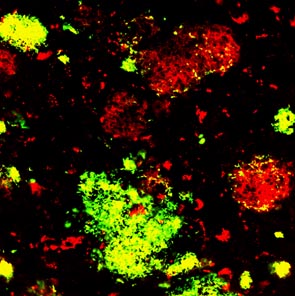
アルツハイマー病の脳にはアミロイド物質が蓄積し、発症の原因となると考えられています。脳アミロイドの主成分はβタンパクですが、これ以外にもアミロイドに固くくっつき、βタンパクの蓄積やアルツハイマー病の発症に影響を与えるタンパク質の存在が想定されてきました。今回我々は、アルツハイマー病の脳にたまったアミロイドから新規の成CLACを同定しました。CLACはコラーゲン状の構造をもち、膜を貫通する形のCLAC前駆体タンパク(25型コラーゲンとも命名されました)から、furinという切断酵素で切り出され、分泌されることも突き止めました。コラーゲンは通常皮膚や血管などの結合組織に大量に存在する線維性のタンパクですが、神経細胞がコラーゲンを作っているということもはじめて分かった事実です。CLACタンパクはβアミロイドに付着することにより、βアミロイドの凝集に影響を与えたり、周囲からの分解に対し抵抗性を与え、アルツハイマー病の発症に影響 を与える可能性が考えられます。このタンパクの存在は1997年にペンシルベニア大のトロジャノフスキー、リー教授らにより予想されていました (Science 277: 31-32, 1997)が、数年にわたる研究の結果、今回我々の研究チームがその同定に成功しました。アミロイド蓄積阻害治療、発症前診断への応用も期待されます。図は抗CLAC抗体9D2と抗βアミロイド抗体で二重染色したアルツハイマー病の脳組織。CLACとβアミロイドが共存する老人斑は黄色に染色されています。
2002年1月28日
新しい論文をNature Cell Biologyに発表しました
α-Synuclein is phosphorylated in synucleinopathy lesions
Hideo Fujiwara, Masato Hasegawa, Naoshi Dohmae, Akiko Kawashima, Eliezer Masliah, Matthew S. Goldberg, Jie Shen, Koji Takio, Takeshi Iwatsubo
Nature Cell Biology 4(2):160-164 (2002)
doi: doi:10.1038/ncb748
高齢者に生じる神経変性疾患の中で、運動機能の冒されるパーキンソン病、アルツハイマー病に似た痴呆症状を示す「Lewy(レビー)小体型痴呆症」の頻度が増加しています。これらの疾患には有効な根本的治療法がなく、その発症機序も不明です。これらの疾患ではα-シヌクレインというたんぱく質が、神経細胞の中で異常を起こし、たとえば” Lewy小体”と呼ばれる線維状の固まり(封入体)をつくって蓄積することが、神経細胞の死滅や症状発現の原因の一つとみられており、まとめて「シヌクレイノパチー」と呼ばれています。しかし正常なα-シヌクレインがどのような原因で線維を形成するのか、線維をつくったα-シヌクレインにはどのような特徴が生じているかには不明の点が多く残されていました。今回我々は、Lewy小体型痴呆症やパーキンソン病の脳にたまったα-シヌクレイン蛋白を分析し、140個ならんだアミノ酸のうちの1個、129番目のセリンが特異的に「リン酸化」を受けていることを証明しました。リン酸化は、たんぱく質の機能を変える生体内の重要な反応ですが、神経細胞に蓄積したたんぱく質のリン酸化は、アルツハイマー病でもタウ蛋白にみられており、パーキンソン病でもα-シヌクレインのリン酸化がその蓄積・細胞障害に重要な役割を果たしている可能性があることがわかりました。またこの発見がシヌクレイノパチーの診断や治療に結びつく可能性も期待されます。パーキンソン病の有病率は人口10万当たり100人に近づきつつあり、特に高齢者ではその数倍に達しようとしています。Lewy小体型痴呆症は、かつてアルツハイマー病と混同される場合もありましたが、老化による痴呆症の原因としてはアルツハイマー病に次いで頻度がたかく、アルツハイマー病の20%前後にのぼることがわかってきました。以上の研究結果は 朝日新聞で紹介 されました。写真はリン酸化α-シヌクレイン特異抗体で染色したDLB脳皮質(緑に染まった球体がLewy小体、突起状に染色されるのがLewy neurite)